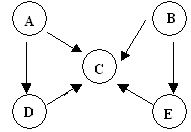
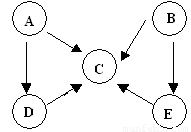
摘要:36.答案: 解析:本题以周期表为题材.考查原子半径比较.酸性强弱.电子式.离子方程式以及盐类水解等知识. (1)⑤⑥位于同一周期.且⑤排在⑥的前面.原子半径大.而④在上一周期.比⑤.⑥少一个电子层.故半径最小. (2)②⑦位于同一主族.上面的非金属性强.最高价含氧酸酸性强.②③位于同一周期.且③在后.非金属性强.对应的酸性强. (3)四种元素分别为氢.氧.钠和氯.离子键显然必须是钠盐.极性共价键则应有两种非金属组成. (4)液态H2O2可以在MnO2.FeCl3等催化剂作用下发生分解反应. (5)⑥为Al.可推断Z为Al(OH)3.受热分解可产物Al2O3.再电解即可得单质铝.M仅含非金属的盐.显然铵盐.所以X与Y应为AlCl3与NH3·H2O的反应.生成NH4Cl.由于NH4+ 水解.故要使其浓度与Cl-相等.则要补充NH3·H2O.由电荷守恒知:C(NH4+ )+ C(H+)C(Cl-)+C(OH-),若C(NH4+ ) C(Cl-).则C(H+)= C(OH-).即pH=7.
网址:http://m.1010jiajiao.com/timu3_id_407477[举报]
在101325 Pa、120℃时,某气态烃和过量O2在一密闭容器内完全燃烧,在相同条件下反应前后容器内的压强相等。求该烃可能的分子式。
解析:本题可采用规律法求解。因分子中氢原子数为4的烃,在相同条件下燃烧前后(水为气态)气体物质的量不变,压强相等。应用这一规律可得该烃的分子式可能为CH4、C2H4或C3H4。
查看习题详情和答案>>
两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )
① a=b+5 ② a+b=8 ③ a+b=30 ④ a=b+8
A.①②③④ B.②③④ C.②③ D.③④
【解析】本题可以采用排除法筛选。①可以是C2H6,②可以是NH3,③可以是AlCl3,④可以是SO3。所以正确的答案是A。
查看习题详情和答案>>
两种短周期元素组成的化合物中,原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )
①a=b+5 ②a+b=8 ③a+b=30 ④ a=b+8
A.①②③④ B.②③④ C.②③ D.③④
【解析】本题可以采用排除法筛选。①可以是C2H6,②可以是NH3,③可以是AlCl3,④可以是SO3。所以正确的答案是A。
查看习题详情和答案>>