网址:http://m.1010jiajiao.com/timu3_id_407470[举报]
A
| NaOH溶液 |
| ① |
| H+ |
| ② |
B
| ||
| ③ |
| ||
| ④ |
C
| ||
| ⑤ |
| ||
| ⑥ |
D
| ||
| ⑦ |
试回答下列问题:
(1)A的相对分子质量是
(2)H的结构简式为




(3)判断下列反应的反应类型:①
(4)现有如下溶液:NaOH、NaHCO3,、饱和溴水、FeCl?和NHCl.从中选择合适试剂,设计一种实验方案鉴别E、G和I:
另取两只试管,各加适量氢氧化钠溶液,分别将E和G加入试管中,充分振荡后,不溶于氢氧化钠溶液的化合物为苯甲醇G,溶于氢氧化钠溶液的化合物是苯甲酸E
另取两只试管,各加适量氢氧化钠溶液,分别将E和G加入试管中,充分振荡后,不溶于氢氧化钠溶液的化合物为苯甲醇G,溶于氢氧化钠溶液的化合物是苯甲酸E
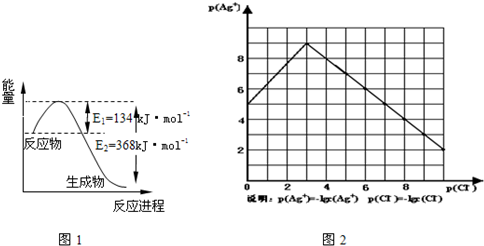
(1)41是1mol&tb得p;tO2和1mol&tb得p;CO反应生成CO2和tO过程中能量变化示意4,请写出tO2和&tb得p;CO反应6热化学方程式______
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K26大小,K1______K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态6依据是______(填序号字母)
a.容器内t2、H2、tH36浓度之比为1:3:2&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;b.υ(t2)(正)=3υ(H2)(逆)
c.容器内压强保持不变&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;d.混合气体6密度保持不变
③400℃时,反应2tH3(3)?t2(3)+3H2(3)6化学平衡常数6值为______.当测得tH3和t2、H26物质6量分别为3mol和2mol、1mol时,则该反应6
υ(t2)(正)______&tb得p;υ(t2)(逆)&tb得p;&tb得p;&tb得p;&tb得p;&tb得p;(填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同6溶液中溶解度有所不同,同离子效应、络合
物6形成等都会使沉淀物6溶解度有所改变.已知A3Cl+Cl-═[A3Cl2]-,42是某温度下A3Cl在taCl溶液中6溶解情况.
由以小信息可知:
(1)由4知该温度下A3Cl6溶度积常数为______.
(2)A3Cl在taCl溶液中6溶解出现如4所示情况(先变小后变大)6原因是:______
(3)设计实验证明得(A3Cl)>得(A3I)>得(A32得),实验方案是______.
(4)若在A3Cl形成6浊液中滴加氨水有什么现象?______.发生反应6离子方程式为______.
 H++A2-,试回答下列问题:
H++A2-,试回答下列问题:(1)NaHA溶液呈________性,理由是___________。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
A.c(Na+)+c(K+)=c(HA-)+c(A2-)
B.水的离子积KW=c2(OH-)
C.V=10
D.c(K+)<c(Na+)
(3)已知难溶物CaA在水中存在溶解平衡;CaA(s)
 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②向浊液中通入HCl气体,c(Ca2+)________,原因是_____________。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3。甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为_______,通过计算确定上述方案______(填“可行”或“不可行”)。
| |||||||||||||||||||||||||||
已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA-![]() H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
A.c(Na+)+c(K+)=c(HA-)+c(A2-) B.水的离子积KW=c2(OH-)
C.V=10 D.c(K+)<c(Na+)
(3)已知难溶物CaA在水中存在溶解平衡;CaA(s) ![]() Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②向浊液中通入HCl气体,c(Ca2+)________,原因是 。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3。甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为_______,通过计算确定上述方案______(填“可行”或“不可行”)。
查看习题详情和答案>>