摘要:6. ⑴2CH3OH +3O2+4OH-==2CO32-+6H2O.⑵负极.下降.13.44L. ⑶①O2+4e-=4O2-,②负极.) 7答案:(1)Al-3e=Al3+ (2)2H2O+O2+4e=4OH- 课后练习 1C 2C 3B 4B 5答案: ⑴Fe一端升高.Ag一端降低.同时Fe端逐渐溶解.Ag端有红色物质析出.水溶液略显浅蓝色,⑵上述变化的原因见解析.
网址:http://m.1010jiajiao.com/timu3_id_40732[举报]
 (2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?泰安三模)SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.(1)上述四种气体中直接排入空气时会引起酸雨的有
NO、NO2、SO2
NO、NO2、SO2
(填化学式).(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1;
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1.
①反应:NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
-41.8
-41.8
kJ?mol-1.②一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g),下列不能说明反应达到平衡状态的是
ad
ad
(填字母).a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1molSO3的同时消耗1molNO2
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示.
①上述合成甲醇的反应为
放热
放热
(填“放热”或“吸热”)反应.②A、B、C三点的平衡常数KA、KB、KC的大小关系为
KA=KB>KC
KA=KB>KC
.③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为
2
2
L.(4)某研究小组设计了如图2所示的甲醇燃料电池装置.
①该电池工作时,OH-向
b
b
(填“a”或“b”)极移动.②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为
2CH3OH+3O2+4OH-=2CO32-+6H2O;
2CH3OH+3O2+4OH-=2CO32-+6H2O;
.二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜( ),有关反应如下:
),有关反应如下:
反应①2CH3OH(l)+H2S(g)=(CH3)2S(l)+2H2O(l)△H=-akJ?mol-1
反应②(CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g)△H=-bkJ??mol-1
反应③2NO(g)+O2(g)=2NO2(g)△H=-ckJ?mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
(2)能说明反应2CH3OH(l)+H2S(g)?(CH3)2S(l)+2H2O(l)达平衡状态的是
A.v(CH3OH)=2v(H2S)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K=
.

(4)上图是反应③在一定条件下发生反应,反应物和生成物能量与活化能的关系.在图中曲线
(5)N2O5是一种新型绿色硝化剂,其制备方法有以下两种.
方法一:4NO2(g)+O2(g)=2N2O5(g);△H=-56.76KJ?mol-1
常温下,该反应能逆向自发进行,则逆向反应的△S
方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:

硼氢化钠燃料电池的正极反应式
查看习题详情和答案>>
 ),有关反应如下:
),有关反应如下:反应①2CH3OH(l)+H2S(g)=(CH3)2S(l)+2H2O(l)△H=-akJ?mol-1
反应②(CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g)△H=-bkJ??mol-1
反应③2NO(g)+O2(g)=2NO2(g)△H=-ckJ?mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
2(CH3)2S(l)+O2(g)=2(CH3)2SO(l)△H=-(2b+c)kJ?mol-1
2(CH3)2S(l)+O2(g)=2(CH3)2SO(l)△H=-(2b+c)kJ?mol-1
,(2)能说明反应2CH3OH(l)+H2S(g)?(CH3)2S(l)+2H2O(l)达平衡状态的是
BC
BC
.A.v(CH3OH)=2v(H2S)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K=
| c2(NO2) |
| C2(NO)c(O2) |
| c2(NO2) |
| C2(NO)c(O2) |

(4)上图是反应③在一定条件下发生反应,反应物和生成物能量与活化能的关系.在图中曲线
b
b
(填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理是催化剂能降低该反应的活化能,提高活化分子的百分数,化学反应速率加快
催化剂能降低该反应的活化能,提高活化分子的百分数,化学反应速率加快
;(5)N2O5是一种新型绿色硝化剂,其制备方法有以下两种.
方法一:4NO2(g)+O2(g)=2N2O5(g);△H=-56.76KJ?mol-1
常温下,该反应能逆向自发进行,则逆向反应的△S
>
>
0(填“>、<”或“=”)方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:

硼氢化钠燃料电池的正极反应式
H2O2+2e-=2OH-
H2O2+2e-=2OH-
. 甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:
甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:途径Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
途径Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2
(1)上述反应符合“原子经济”规律的是
(2)下列各项中,能够说明反应Ⅱ已达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CO、H2和CH3OH的浓度保持不变
c.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH3OH
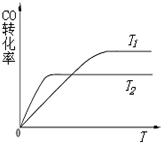
(3)如图是反应途径Ⅱ在不同温度下CO的转化率随时间变化的曲线.
①该反应的焓变△H2_
②如表所列数据是反应途径Ⅱ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 350℃ |
| K | 2.041 | 0.012 |
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ?mol-1
③H2O(g)=H2O(l)△H=-c kJ?mol-1
则,CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=
(5)用甲醇作燃料,KOH溶液作电解液,惰性电极材料组成的原电池工作时,其正极反应式
(2011?扬州三模)二甲醚与水蒸气重整制氢气作为燃料电池的氢源,比其他制氢技术更有优势.主要反应为:
①CH3OCH3(g)+H2O(g)?2CH3OH(g)△H=+37kJ?mol-1
②CH3OH(g)+H2O(g)?3H2(g)+CO2(g)△H=+49kJ?mol-1
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1
其中反应③是主要的副反应,产生的CO能毒害燃料电池Pt电极.请回答下列问题:
(1)CH3OCH3(g)与水蒸气重整制氢气的热化学方程式为
(2)下列采取的措施和解释正确的是
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在低温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,对制取氢气不利,且对减少CO的产生几乎无影响
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下.
下列说法正确的是
A.a+2c=37 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极也可直接构成燃料电池.该电池中负极上的电极反应式是
查看习题详情和答案>>
①CH3OCH3(g)+H2O(g)?2CH3OH(g)△H=+37kJ?mol-1
②CH3OH(g)+H2O(g)?3H2(g)+CO2(g)△H=+49kJ?mol-1
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1
其中反应③是主要的副反应,产生的CO能毒害燃料电池Pt电极.请回答下列问题:
(1)CH3OCH3(g)与水蒸气重整制氢气的热化学方程式为
CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H=135kJ?mol-1
CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g)△H=135kJ?mol-1
.(2)下列采取的措施和解释正确的是
ABD
ABD
.(填字母序号)A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在低温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,对制取氢气不利,且对减少CO的产生几乎无影响
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
ABC
ABC
.(填字母序号)A.a+2c=37 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极也可直接构成燃料电池.该电池中负极上的电极反应式是
CH3OCH3+16OH--12e-=2CO32-+11H2O
CH3OCH3+16OH--12e-=2CO32-+11H2O
.