摘要:4.电解原理及其应用 直流电通过电解质溶液时使阴阳两极发生氧化还原反应的过程.电解是一个电能转化为化学能的过程. 从参加反应的物质来分电解反应可分成五类: (1)H2O型:实质是电解水.如电解硝酸钠.氢氧化钠.硫酸等溶液. (2)溶质型:溶质所电离出来的离子发生氧化还原.如电解氯化铜.溴化氢等溶液. (3)硫酸铜溶液型:电解产物是金属.氧气与酸.如电解硫酸铜溶液生成单质铜.氧气和硫酸.电解硝酸银溶液时生成单质银.氧气和硝酸. (4)氯化钠溶液型:电解产物是非金属单质.氢气与碱.如电解氯化钠溶液时生成氯气.氢气和氢氧化钠.电解溴化钾溶液时生成溴单质.氢气和氢氧化钾. (5)电镀型:镀层金属作阳极.阳极反应是:M- ne-=Mn+.镀件作阴极.阴极反应是:Mn++ne-=M.(电解精炼与电镀.实质上是相同的) [典型题析] [例1]熔融盐燃料电池具有高的发电效率.因而受到重视.可用Li2CO3和Na2CO3的熔融盐混和物作电解质.CO为负极燃气.空气与CO2的混和气为正极助燃气.制得在650℃下工作的燃料电池.完成有关的电池反应式: 负极反应式:2CO+2CO32--4e-= 4CO2 正极反应式: 总电池反应式: [解析]本题属于那种源于教材又高于教材的题型.从通常原电池的电解质溶液.一下过渡到熔融盐.不少人无法适应.当年高考失分也很严重.其实.我们只要从最基本的一点-燃料电池分析.其总电池反应式应为:2CO+O2=2CO2.然后逆向思考正极反应式-应为总反应式减去负极反应式.就可得出结果: O2+2CO2+4e-=2CO32-. [例2]普通干电池中装有二氧化锰和其它物质.二氧化锰的作用是 ( ) A. 和正极作用把碳变成CO2 B. 把正极附近生成的H2氧化成水 C. 电池中发生化学反应的催化剂 D. 和负极作用.将锌变成锌离子Zn2+ [解析]锌锰干电池的负极材料是锌.故负极反应是Zn-2e-=Zn2+.正极导电材料是石墨棒.两极间为MnO2.NH4Cl.ZnCl2的糊状物.正极NH4+发生还原反应生成NH3和(H).继而被MnO2氧化为水.使碳极附近不致产生H2气泡而使电极极化.故MnO2也可称为正极的去极剂.使正极附近生成的H2氧化为水.正极反应: 2MnO2+2NH4++2e-==Mn2O3+2NH3+H2O 电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O 本题答案为B. [例3]将0.lmol·醋酸溶液加水稀释.下列说法正确的是( ) A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大 C.醋酸电离平衡向左移动 D.溶液的pH增大 [解析]答案为D. 主要考查电离平衡知识.弱酸的电离可联系到溶液的pH.物质的量浓度.水的电离平衡等基础知识.要用到化学平衡移动原理.要注意酸溶液稀释时.溶液的c(OH-)增大.同样碱溶液稀释时溶液中的c(H+)增大. [例4]已知0.1mol·L-1的二元酸H2A溶液的pH=4.0.则下列说法中正确的是( ) A.在Na2A.NaHA两溶液中.离子种类不相同 B.在溶质物质的量相等的Na2A.NaHA两溶液中.阴离子总数相等 C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-) D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)> c(OH-) [解析]答案选C. 主要考查电离平衡.盐类水解等理论知识.弱电解质的电离平衡.盐类的水解平衡都会反映到溶液中各种离子浓度的关系之中.从分析离子关系角度考查电离平衡和盐类水解平衡理论知识.可以较好地区分学生对相关理论内容的理解水平. 根据题给条件可判断.H2A的第一级电离就较弱.属于弱酸.所以在Na2A.NaHA溶液中由于水解和电离.两溶液中所含离子种类数肯定相同.在Na2A溶液中.由于A2-水解.阴离子总数增加.在NaHA溶液中由于HA-水解阴离子总数要减小.所以两溶液中阴离子总数前者多.任何溶液中.阳离子所带正电荷总数跟阴离子所带负电荷总数必定相等.所以.在Na2A溶液中H+浓度小于OH-离子浓度. [例5]剪长约6cm.宽2cm的铜片.铝片各一片.分别用接线柱平行地固定在一块塑料板上.将铜片与铝片分别和电流表的“+ .“- 端相连接.电流表指针调到中间位置.取两个50mL的小烧杯.在一个烧杯中注入约40mL的浓硝酸.在另一只烧杯中注入40mL0.5mol/L的硫酸溶液.试回答下列问题: (1)两电极同时插入稀硫酸中.电流表指针偏向 极.铝片上电极反应式为 , (2)两电极同时插入浓硝酸时.电流表指针偏向 极.此时铝是 极.铝片上电极反应式为 . [解析]电极的确定依赖于具体的电极反应.在这个问题上.学生易受思维定势的影响.以为金属越活泼.便一定是负极.殊不知.在浓硝酸中.Al表面产生了钝化.发生反应的是Cu.因此.当Al.Cu同时插入稀硫酸时.电流表指针偏向Al..电极反应式为:Al-3e-=Al3+.而当Al.Cu同时插入浓硝酸时.电流表指针偏向Cu.Al作正极.且电极反应式为:NO3-+4H++3e-=NO+2H2O. [预测与训练]
网址:http://m.1010jiajiao.com/timu3_id_40703[举报]
某课外小组分别用图所示装置对原电池和电解原理及其应用进行实验探究.请回答以下问题.
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为
(3)实验过程中,SO42-
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-═FeO42-+4H2O 和
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
III、分别放在图3装置(都盛有0.1mol?L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是
(8)利用图4装置,可以模拟铁的电化学防护.其中X为碳棒,为减缓铁的腐蚀,开关K应置于
查看习题详情和答案>>
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是
A
A
(填字母序号).A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为
2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-)
2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-)
.(3)实验过程中,SO42-
从右向左
从右向左
(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有滤纸上有红褐色斑点产生
滤纸上有红褐色斑点产生
.II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH
增大
增大
(填“增大”、“减小”或“不变”).(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-═FeO42-+4H2O 和
4OH--4e-═2H2O+O2↑
4OH--4e-═2H2O+O2↑
.(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
0.28
0.28
g.III、分别放在图3装置(都盛有0.1mol?L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是
C
C
.(8)利用图4装置,可以模拟铁的电化学防护.其中X为碳棒,为减缓铁的腐蚀,开关K应置于
N
N
处.若X为锌,开关K置于M处,该电化学防护法称为外加电流的阴极保护法
外加电流的阴极保护法
.
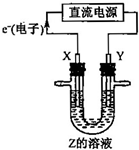 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) 利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生
利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生