摘要:影响社会经济发展和进步的新科技革命三大支柱通常是指( ) ①能源 ②交通 ③通讯 ④材料 ⑤信息工程 A.①②③ B.①③⑤ C.②③⑤ D.①④⑤
网址:http://m.1010jiajiao.com/timu3_id_404648[举报]
环境问题已经成为制约社会发展和进步的严重问题,下列叙述正确的是……………( )
①臭氧层的主要作用是吸收紫外线,保护地球生物 ②温室效应将会导致全球气候变暖
③光化学烟雾主要是由汽车排放的尾气引起的 ④酸雨主要是由于空气受到硫的氧化物和氮的氧化物污染所致
A. ①② B. ②③
C. ①②③ D. ①②③④
查看习题详情和答案>>
环境问题已经成为制约社会发展和进步的严重问题,下列叙述正确的是……………( )
①臭氧层的主要作用是吸收紫外线,保护地球生物 ②温室效应将会导致全球气候变暖
③光化学烟雾主要是由汽车排放的尾气引起的 ④酸雨主要是由于空气受到硫的氧化物和氮的氧化物污染所致
A. ①② B. ②③
C. ①②③ D. ①②③④
查看习题详情和答案>>
(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙的时候,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激.如果只用一种金属器械去触动青蛙,就无此种反应.伽伐尼认为出现这种现象的原因是动物体内存在“生物电”.结合你所学的知识模拟该过程,下列哪种材质的手术刀触碰铁盘上的青蛙腿不会产生触动?
a 铝 b 陶瓷 c 塑料 d 铁
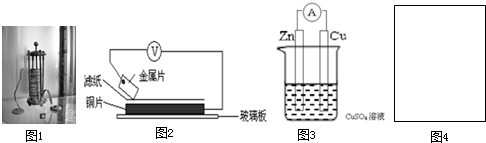
(2)1799年,伏打仔细研究了伽伐尼的发现,以含食盐水的湿抹布,夹在银和锌的圆形版中间,堆积成圆柱状,制造出世界上最早的电池-伏打电池(图1). 将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如图2所示).在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据表中数据判断:
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个能够获得稳定电流的电池,图3是丹尼尔电池的简易装置:
该电池的正极是
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来.请选择适宜的材料和试剂设计一个原电池,使它的正极反应为:Fe3++e-=Fe2+以“ ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
查看习题详情和答案>>
bcd
bcd
(填字母)a 铝 b 陶瓷 c 塑料 d 铁

(2)1799年,伏打仔细研究了伽伐尼的发现,以含食盐水的湿抹布,夹在银和锌的圆形版中间,堆积成圆柱状,制造出世界上最早的电池-伏打电池(图1). 将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如图2所示).在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
| 金属 | 电子流动方向 | 电压(V) |
| A | A→Cu | +0.78 |
| B | Cu→B | -0.15 |
| D | D→Cu | +1.35 |
| E | E→Cu | +0.30 |
D
D
金属可能是最强的还原剂;B
B
金属一定不能从硫酸铜溶液中置换出铜.(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个能够获得稳定电流的电池,图3是丹尼尔电池的简易装置:
该电池的正极是
铜
铜
,负极是锌
锌
,正极反应是Cu2++2e-=Cu
Cu2++2e-=Cu
,负极反应是Zn-2e-=Fe2+
Zn-2e-=Fe2+
.(4)随着社会的发展和科技的进步,越来越多的电池被制造出来.请选择适宜的材料和试剂设计一个原电池,使它的正极反应为:Fe3++e-=Fe2+以“
 ”代表反应容器,“
”代表反应容器,“ ”代表导线,“
”代表导线,“ ”代表电极,“
”代表电极,“ ”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
”代表小灯泡,在右侧方框(图4)内画出装置图并指出电极材料和电解质溶液,标出电源的正负极.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选择其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A:
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为 .
(2)写出基态Cu+的核外电子排布式 .
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 .
(4)写出与CO互为等电子体的离子 .(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为 ;1mol尿素分子中,σ键的数目为 .
(6)铜金合金形成的晶胞如图1所示,其中Cu、Au原子个数比为 .
B:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到.
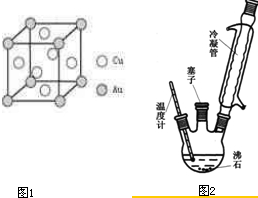
实验室可利用如图2实验装置合成对氨基苯磺酸.实验步骤如下:
1在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.
2将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5h.
③将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(说明:100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g.)
试回答填空.
(1)装置中冷凝管的作用是 .
(2)步骤②中采用油浴加热,下列说法正确的是 (填序号).
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是 .
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先 ,然后 ,以防倒吸.
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是 .每次抽滤后均应将母液收集起来,进行适当处理,其目的是 .
查看习题详情和答案>>
A:
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为
(2)写出基态Cu+的核外电子排布式
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为
(4)写出与CO互为等电子体的离子
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为
(6)铜金合金形成的晶胞如图1所示,其中Cu、Au原子个数比为
B:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到.

实验室可利用如图2实验装置合成对氨基苯磺酸.实验步骤如下:
1在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.
2将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5h.
③将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(说明:100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g.)
试回答填空.
(1)装置中冷凝管的作用是
(2)步骤②中采用油浴加热,下列说法正确的是
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是