网址:http://m.1010jiajiao.com/timu3_id_404580[举报]
(1)已知氢氧化铁可以被次氯酸钠氧化成![]() ,当3.21 g Fe(OH)3参加反应时,反应中共转移了0.09 mol电子,则n=________.
,当3.21 g Fe(OH)3参加反应时,反应中共转移了0.09 mol电子,则n=________.
(2)根据上题推断结果,配平下列离子方程式:
[ ]Fe(OH)3+[ ]ClO-+[ ]OH-——[ ]FeO4n-+[ ]Cl-+[ ]H2O
(3)结合以上反应,推测FeO4n-能与下列哪些物质反应(填序号)________.
A.Cl2
B.SO2
C.H2S
D.O2
(10分) 按要求填空
(1) 配平下列化学方程式:
______P + ________FeO + _______CaO =_______Ca3(PO4)2 +_________Fe
(2) 制造光导纤维的材料是_________;三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(3) 除去NaHCO3溶液中少量的Na2CO3杂质相应的离子方程式为__________________________________________。
(4) 检验SO42-所需要用的试剂__________________和__________________。
(10分) 按要求填空
(1) 配平下列化学方程式:
______P + ________FeO + _______CaO =_______Ca3(PO4)2 +_________Fe
(2) 制造光导纤维的材料是_________;三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(3) 除去NaHCO3溶液中少量的Na2CO3杂质相应的离子方程式为__________________________________________。
(4) 检验SO42-所需要用的试剂__________________和__________________。
查看习题详情和答案>>
(10分) 按要求填空
(1) 配平下列化学方程式:
______P +________FeO + _______CaO =_______Ca3(PO4)2 +_________Fe
(2) 制造光导纤维的材料是_________;三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(3) 除去NaHCO3溶液中少量的Na2CO3杂质相应的离子方程式为__________________________________________。
(4) 检验SO42-所需要用的试剂__________________和__________________。
查看习题详情和答案>>
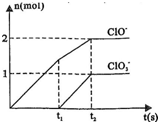 已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、
已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、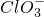 ;三种含氯元素的离子,其中C1O-、
;三种含氯元素的离子,其中C1O-、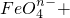 ______Cl-+______H2O.
______Cl-+______H2O.