摘要:8.A 正反应为放热反应.前者恒温.后者相对前者.温度升高.使平衡向左移动.从而 使Br2的转化率降低.所以a>b.
网址:http://m.1010jiajiao.com/timu3_id_404459[举报]
 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
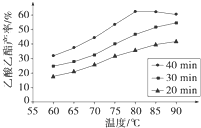
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃.在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示.(1)该研究小组的实验目的是
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是
Ⅱ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)??H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
C(s)+H2O(g)??CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2O(g)??H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是
(3)在V L密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2 842kJ(已知CO燃烧热为283kJ?mol-1,H2燃烧热为286kJ?mol-1),则T℃平衡常数K=