网址:http://m.1010jiajiao.com/timu3_id_40406[举报]
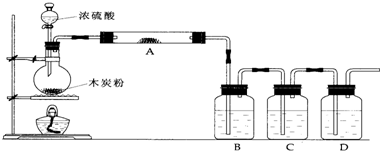
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气.
答:
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
| ||
| ||
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是
B中加入的试剂是
C中加入的试剂是
D中加入的试剂是
(4)实验时,C中应观察到的现象是

实验前先检查装置的气密性。实验开始时,先关闭活塞a,并取下烧杯B,向A中加入一定量浓度适当的盐酸,产生氢气。经必要的“操作”〔见问题(2)〕后,在导管的出口处点燃氢气,然后如图6-52所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧,用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入烧杯E中,使酚酞试液呈红色。请回答下列问题。
(1)实验前如何检查装置的气密性?
(2)点燃氢气前必须进行__________,该操作的方法是__________。
(3)写出B、D中分别发生反应的化学方程式:
B中:______________________;
D中:________________。
(4)C中所盛干燥剂的名称是_________,该干燥剂的作用是______________________。
查看习题详情和答案>>
图6-26
实验前先检查装置的气密性。实验开始时,先关闭活塞a,并取下烧杯B,向A中加入一定量浓度适当的盐酸,产生氢气。经必要的“操作”〔见问题(2)〕后,在导管的出口处点燃氢气,然后如图所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧,用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入烧杯E中,使酚酞试液呈红色。请回答下列问题。
(1)实验前如何检查装置的气密性?__________________________。
(2)点燃氢气前必须______________,该操作的方法是__________________。
(3)写出B、D中分别发生反应的化学方程式:
B中:___________________________________________;
D中:____________________________________________。
(4)C中所盛干燥剂的名称是________,该干燥剂的作用是_________________________。
查看习题详情和答案>>有下图所示的实验装置.图中:A是简易的氢气发生器;B是大小适宜的圆底烧瓶;C是装有干燥剂的U形管;a是旋转活塞;D是装有还原铁粉的反应管;E是装有酚酞的烧杯.实验前先检查装置的气密性.实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量的盐酸(浓度适当),产生氢气.经必要的操作[见问题(2)]后,在导管的出口处点燃氢气,然后如下图所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧.用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入烧杯E中,使酚酞试液呈红色.请回答下列有关问题.
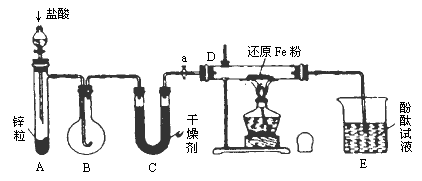
(1)实验前如何检查装置的气密性?
答:________________________________________________.
(2)点燃氢气前必须进行________操作,该操作方法是________.
(3)写出B、D中分别发生反应的化学方程式.B:________;D:________.
(4)C中所盛干燥剂的名称是________,该干燥剂的作用是________.
查看习题详情和答案>>为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。




(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。
装置A中能产生二氧化碳的化学方程式为 。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。
重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。
(5Fe2+ + MnO4—+ 8H+ ==5Fe3+ + Mn2+ + 4H2O)。
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L—1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 。(填字母序号)

③滴定过程中 (填“需要”或“不需要”)加入指示剂,如需要,应加入的指示剂是 。
④铁碳合金中铁元素的质量分数为 。
查看习题详情和答案>>