网址:http://m.1010jiajiao.com/timu3_id_40391[举报]
 (1)如何检查D装置的气密性?
(1)如何检查D装置的气密性?(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为
| ||
| ||
(3)在A中盛有CaCO3,a中盛有6mol?L-1盐酸.为使A中产生的CO2在进入D之前既干燥又纯净,B、C处应设置和各仪器中应盛有何种试剂?
(4)实验时,D和E的橡胶塞为什么最好用铝箔包住?
(5)反应过程中要不断地通入CO2,其主要作用是:①
(6)E中进行的反应是:2Fe+3Br2=2FeBr3,2FeBr3=2FeBr2+Br2↑.此实验中溴化亚铁的产率为
(7)为防止污染空气,实验时应在F处连接盛有
下列叙述中正确的是……( )
A、氯水、亚硫酸、活性炭的漂白或脱色原理虽然不同,但它们都能使品红或墨迹褪色;
B、将等物质的量的Cl2和SO2同时与潮湿的红布条作用,颜色立即褪色;
C、将等物质的量的Cl2和SO2同时与潮湿的红布条作用,颜色基本不褪;
D、经Cl2和SO2漂白的物质,日久都会恢复原来的颜色。
查看习题详情和答案>>实验室用下图所示的装置制取溴化亚铁。其中,A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两只耐高温的瓷夹,其中共盛有56g细铁粉。实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中的物质开始反应,不断地将d中的液溴滴入100~120℃的D中,经过几小时的连续反应后在不锈钢管一端沉积有黄绿色鳞片状溴化亚铁80g。
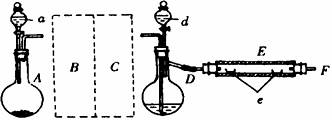
(1)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为 。
(2)在A中盛有CaCO3,a中盛有6mol?L-1盐酸。为使A中产生的CO2在进入D之前既干燥又纯净,B、C处采用相同的玻璃仪器,其仪器名称为 ;B盛有的试剂是: ;C盛有的试剂是: .
(3)实验时,D和E的橡胶塞为什么最好用铝箔包住?
(4)反应过程中要不断地通入CO2,其主要作用是: 。
(5)E中在加热时进行的反应是:2Fe+3Br2=2FeBr3,2FeBr3=2FeBr2+Br2↑。此实验中溴化亚铁的产率为 。(保留到小数点后一位)
查看习题详情和答案>>