摘要:14.常温下.0.1 mol L-1某一元酸(HA).下列正确的是 A.该溶液中由水电离出的 B.0.1mol/L的NaA溶液中的离子浓度大小关系为: C.该溶液中水的离子积常数为l×10-12 D.用0.1 mol L-1 NaOH溶液V1L与0.1 mol·L-1该一元酸(HA)V2L溶液混合.若混合溶液的pH=7.则V1<V2
网址:http://m.1010jiajiao.com/timu3_id_403557[举报]
常温下,0.1 mol·L-1某一元酸(HA)溶液中![]() ,下列叙述正确的是
,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
查看习题详情和答案>>常温下,0.1 mol·L-1某一元酸(HA)溶液中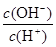 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液c(OH-)均增大
查看习题详情和答案>>
常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
- A.溶液中水电离出的c(H+)=10-10 mol·L-1
- B.溶液中c(H+)+c(A-)=0.1 mol·L-1
- C.与0.05 mol·L-1NaOH溶液等体积混合所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
- D.原溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
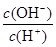 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是