摘要:10.(1)试管没垂直,滴管口接触管壁. (2)试管底部放在酒精灯焰芯上,管内液体体积超过试管容积的1/3,大拇指按在试管夹的短柄上. (3)温度计的水银球插在乙醇溶液中. (4)玻璃棒没有接触滤纸.
网址:http://m.1010jiajiao.com/timu3_id_40271[举报]
(2009?海淀区一模)乙二酸通常以二水合物的形式存在,俗称草酸晶体.已知草酸晶体在101℃时熔化并开始升华,157℃时大量升华,继续升温会分解生成CO、CO2和H2O.
(1)下列关于乙二酸的叙述正确的是(填编号)
①能和乙二醇发生酯化反应
②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红
④能和碳酸氢钠溶液反应生成气体
欲验证上述性质,除用到胶头滴管、试管和玻璃导管外,还必需要使用的玻璃仪器有
(2)乙二酸的工业生产方法之一是以乙二醇为原料,在一定条件下,用空气氧化得到.写出该反应的化学反应方程式
 .
.
(3)欲检验草酸晶体受热分解的产物中是否有CO2,甲、乙两位同学分别设计了装置1、装置2来完成实验.

(I)简述检验装置1气密性的操作方法
(II)B和E两个装置中更合理的是
(III)请从A~F中选择合适的仪器,组装一套可更好达到实验目的装置,按照气流由左到右的顺序依次为(用字母表示):
查看习题详情和答案>>
(1)下列关于乙二酸的叙述正确的是(填编号)
①②③④
①②③④
.①能和乙二醇发生酯化反应
②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红
④能和碳酸氢钠溶液反应生成气体
欲验证上述性质,除用到胶头滴管、试管和玻璃导管外,还必需要使用的玻璃仪器有
酒精灯
酒精灯
、玻璃棒
玻璃棒
.(2)乙二酸的工业生产方法之一是以乙二醇为原料,在一定条件下,用空气氧化得到.写出该反应的化学反应方程式


(3)欲检验草酸晶体受热分解的产物中是否有CO2,甲、乙两位同学分别设计了装置1、装置2来完成实验.

(I)简述检验装置1气密性的操作方法
如图连接好装置,将导管b没入水中,微热(或手捂)试管a,看到导管口处有气泡冒出,撤火(或松手)后,观察到导管内有一段水柱上升,则说明该装置的气密性良好
如图连接好装置,将导管b没入水中,微热(或手捂)试管a,看到导管口处有气泡冒出,撤火(或松手)后,观察到导管内有一段水柱上升,则说明该装置的气密性良好
.(II)B和E两个装置中更合理的是
E
E
,理由为B中的导管过长、过细,冷凝后的乙二酸晶体可能会堵塞导管而存在安全隐患;E中采用U型管,与冰水的接触面积更大,更有利于乙二酸蒸气的冷凝,防止了乙二酸蒸气干扰CO2的检验
B中的导管过长、过细,冷凝后的乙二酸晶体可能会堵塞导管而存在安全隐患;E中采用U型管,与冰水的接触面积更大,更有利于乙二酸蒸气的冷凝,防止了乙二酸蒸气干扰CO2的检验
.(III)请从A~F中选择合适的仪器,组装一套可更好达到实验目的装置,按照气流由左到右的顺序依次为(用字母表示):
A、E、F
A、E、F
.为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程.某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
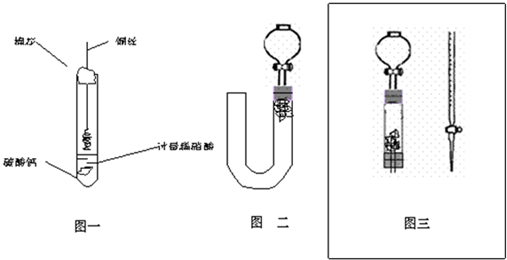
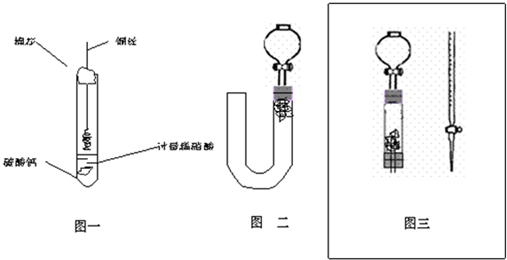
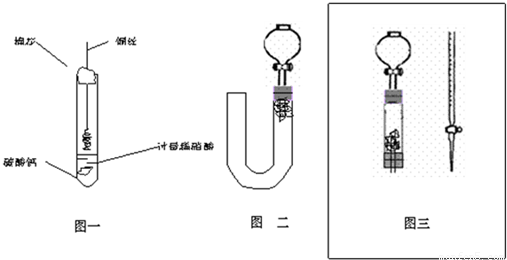
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会
②反应开始后,因为随着NO的体积增加,
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
查看习题详情和答案>>

(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:
除去装置内的空气,防止生成的NO被氧化而影响实验效果
除去装置内的空气,防止生成的NO被氧化而影响实验效果
.(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会
因如图所示的铜丝所在空间中被封闭一段空气
因如图所示的铜丝所在空间中被封闭一段空气
而使后面的实验无法观察到预期现象.
②反应开始后,因为随着NO的体积增加,
产生的NO排开酸液而与大部分铜丝脱离接触
产生的NO排开酸液而与大部分铜丝脱离接触
影响铜丝与硝酸的继续反应.(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达
分液漏斗最大量程刻度处
分液漏斗最大量程刻度处
,设定有条件精确称量,还需要的数据是铜丝反应前后的质量
铜丝反应前后的质量
.(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程.某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
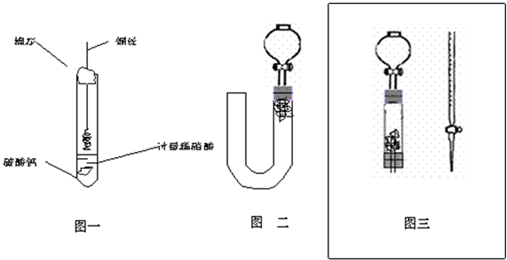
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:______.
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会______而使后面的实验无法观察到预期现象.
②反应开始后,因为随着NO的体积增加,______影响铜丝与硝酸的继续反应.
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达______,设定有条件精确称量,还需要的数据是______.
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
查看习题详情和答案>>
为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程.某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:______.
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会______而使后面的实验无法观察到预期现象.
②反应开始后,因为随着NO的体积增加,______影响铜丝与硝酸的继续反应.
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达______,设定有条件精确称量,还需要的数据是______.
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
查看习题详情和答案>>

(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:______.
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会______而使后面的实验无法观察到预期现象.

②反应开始后,因为随着NO的体积增加,______影响铜丝与硝酸的继续反应.
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达______,设定有条件精确称量,还需要的数据是______.
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程.某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:______.
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会______而使后面的实验无法观察到预期现象.
②反应开始后,因为随着NO的体积增加,______影响铜丝与硝酸的继续反应.
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达______,设定有条件精确称量,还需要的数据是______.
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
 查看习题详情和答案>>
查看习题详情和答案>>

(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:______.
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会______而使后面的实验无法观察到预期现象.
②反应开始后,因为随着NO的体积增加,______影响铜丝与硝酸的继续反应.
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达______,设定有条件精确称量,还需要的数据是______.
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
 查看习题详情和答案>>
查看习题详情和答案>>