摘要:某教材中有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸.将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3和Na2CO3同时倒入试管中.观察到现象如右图: (1)盛 的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为 . (2)甲同学用手触摸试管.发现盛NaHCO3粉末的试管变冷.而盛Na2CO3粉末的试管变热.由此他得出:不管其状态如何.NaHCO3和HCl反应为吸热反应.而Na2CO3和HCl反应为放热反应.甲同学写出了如下热化学方程式(其中“aq 代表水合或无限稀释的含义): HCO3-(aq)+ H+(aq) →H2O(l)+ CO2(g) +Q1, Q1<0 CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) +Q2, Q2 >0 甲同学所作结论的方法是否正确? . (3)为研究该反应是吸热还是放热反应.某研究小组以为研究课题.进行了如下实验(每次实验各做三次.取平均值): 序号 试剂1 试剂2 混合前温度 混合后最高 或最低温度 ① 35mL水 2.5g NaHCO3固体 20℃ 18.5℃ ② 35mL水 3.2 Na2CO3固体 20℃ 24.3℃ ③ 35mL稀盐酸 含2.5g NaHCO3的饱和溶液32.5mL 20℃ 19℃ ④ 35mL稀盐酸 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 20℃ 24.2℃ ⑤ 35mL稀盐酸 2.5gNaHCO3固体 20℃ 16.2℃ ⑥ 35mL稀盐酸 3.2g Na2CO3固体 20℃ 25.1℃ 请你帮助填写相关内容: 该实验中所用的仪器除试管.药匙.气球.玻璃棒.烧杯.量筒.保温瓶外.还需要的仪器名称为 和 , (4)通过上述实验可以得出 . A.NaHCO3的溶解是吸热过程 B.NaHCO3的饱和溶液和盐酸的反应是吸热反应 C.Na2CO3的溶解是放热过程 D.Na2CO3的饱和溶液和盐酸的反应是吸热反应 (5)结论:影响NaHCO3固体与稀盐酸反应的反应热因素有 .
网址:http://m.1010jiajiao.com/timu3_id_40204[举报]
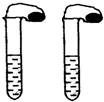 高中教材中有这样一个实验:在两支同样大小的试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:
高中教材中有这样一个实验:在两支同样大小的试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:(1)试管中(填产生沉淀或气体及反应速率等相关现象)
(2)盛NaHCO3的试管中气球变得更大,大小气球体积之比约为(填最简整数比)
(3)等质量的两种固体完全反应后生成气体质量不等,但等质量的稀盐酸完全反应后生成气体质量相等,这个结论正确吗?
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个分别装有0.3g NaHCO3、0.3g Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3、Na2CO3同时倒入试管中,观察.反应方程式:NaHCO3+HCl═NaCl+H2O+CO2↑
Na2CO3+2HCl═2NaCl+H2O+CO2↑
①两试管中气球大小(包含试管) 体积之比约为(填最简单整数比)(盐酸均足量) ;
②甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲下结论的方法是否正确 (填正确或不正确)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做了3次平行实验,取平均值)
请你帮助填写相关内容:
①该研究报告的题目是《 》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为 和 ;通过上述实验可得出多条结论,如:
a:NaHCO3的溶解是 (吸热或放热)过程;
b:Na2CO3的饱和溶液和盐酸的反应是 (吸热或放热)反应.
查看习题详情和答案>>
Na2CO3+2HCl═2NaCl+H2O+CO2↑
①两试管中气球大小(包含试管) 体积之比约为(填最简单整数比)(盐酸均足量)
②甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲下结论的方法是否正确
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做了3次平行实验,取平均值)
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 23.0℃ |
| ③ | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
| ④ | 35mL稀盐酸 | 含3.2gNa2CO3的饱和溶液15mL水 | 20℃ | 20.6℃ |
| ⑤ | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 17.4℃ |
| ⑥ | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 23.5℃ |
①该研究报告的题目是《
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为
a:NaHCO3的溶解是
b:Na2CO3的饱和溶液和盐酸的反应是
原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口,将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
(1)两支试管均产生大量气体,投入
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲同学写出了下列热化学方程式(其中“aq”的含义是表示水溶液):HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H>0 CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)△H<0
甲下结论的方法是否正确
请你帮助填写相关内容:
该研究报告的题目可拟为《
通过上述实验可得出四条结论:
①NaHCO3的溶解是
②Na2CO3的溶解是
③NaHCO3的饱和溶液和盐酸的反应是
④Na2CO3的饱和溶液和盐酸的反应是
查看习题详情和答案>>
(1)两支试管均产生大量气体,投入
NaHCO3
NaHCO3
的试管中气体产生较快,投入NaHCO3
NaHCO3
的试管中气球变得更大(以上均填化学式).(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲同学写出了下列热化学方程式(其中“aq”的含义是表示水溶液):HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H>0 CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)△H<0
甲下结论的方法是否正确
不正确
不正确
(填“正确”或“不正确”);为研究是吸热还是放热反应,乙同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
该研究报告的题目可拟为《
NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究(或相关内容)
NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究(或相关内容)
》通过上述实验可得出四条结论:
①NaHCO3的溶解是
吸热
吸热
(填“吸热”或“放热”)过程;②Na2CO3的溶解是
放热
放热
(填“吸热”或“放热”)过程;③NaHCO3的饱和溶液和盐酸的反应是
吸热
吸热
(填“吸热”或“放热”)反应;④Na2CO3的饱和溶液和盐酸的反应是
放热
放热
(填“吸热”或“放热”)反应.(16分)原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
(1)两支试管均产生大量气体,盛 的试管中气体产生较快,盛 的试管中气球变得更大;
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3—(aq)+ H+(aq) ="===" H2O(l)+ CO2(g) △H>0
CO32—(aq)+ 2H+(aq) ="===" H2O(l)+ CO2(g) △H<0
甲下结论的方法是否正确 (填“正确”或“不正确”)
(3)为研究是吸热还是放热反应,乙同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合 前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出五条结论
a:NaHCO3的溶解是 (吸热或放热)过程;
b:Na2CO3的溶解是 (吸热或放热)过程;
c:NaHCO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
d:Na2CO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
e:NaHCO3固体与稀盐酸反应的反应热是由 (填a→d的字母)的热效应之和。 查看习题详情和答案>>
原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口,将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
(1)两支试管均产生大量气体,投入______的试管中气体产生较快,投入______的试管中气球变得更大(以上均填化学式).
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲同学写出了下列热化学方程式(其中“aq”的含义是表示水溶液):HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H>0 CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)△H<0
甲下结论的方法是否正确______(填“正确”或“不正确”);为研究是吸热还是放热反应,乙同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
该研究报告的题目可拟为《______》
通过上述实验可得出四条结论:
①NaHCO3的溶解是______ (填“吸热”或“放热”)过程;
②Na2CO3的溶解是______ (填“吸热”或“放热”)过程;
③NaHCO3的饱和溶液和盐酸的反应是______(填“吸热”或“放热”)反应;
④Na2CO3的饱和溶液和盐酸的反应是______(填“吸热”或“放热”)反应. 查看习题详情和答案>>