摘要:实验探究是体验知识的产生或形成过程的基本途径.下面是某同学探究实验报告的一部分.请填空: 实验名称:氯.溴.碘的氧化性强弱比较 实验药品:NaCl溶液.KBr溶液.KI溶液.氯水.溴水.四氯化碳.淀粉碘化钾试纸 实验步骤 实验结论 ①NaCl溶液+氯水+1ml CCl4.振荡.静置.观察Cl4溶液 氧化性从强到弱的顺序:氯.溴.碘 ②NaBr溶液+氯水+1ml CCl4.振荡.静置.观察Cl4溶液 ③Kl溶液+氯水+1ml CCl4.振荡.静置.观察Cl4溶液 (1)完成该实验需用到的仪器是 , (2)CCl4在实验中所起的作用是 , (3)在实验②中四氯化碳层颜色变化过程为 , (4)该同学的实验缺陷是 .改进的办法是 .
网址:http://m.1010jiajiao.com/timu3_id_40166[举报]
实验探究是体验知识的产生或形成过程的基本途径。下面是某同学探究实验报告的一部分,请填空:
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳、淀粉碘化钾试纸
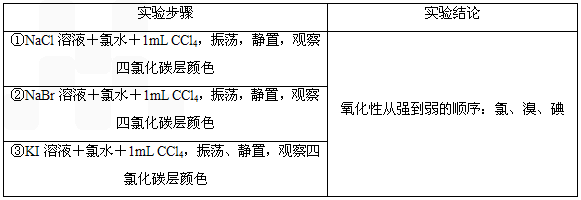
| 实验步骤 | 实验结论 |
| ①NaCl溶液+氯水+1ml CCl4,振荡、静置、观察Cl4溶液 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1ml CCl4,振荡、静置、观察Cl4溶液 | |
| ③Kl溶液+氯水+1ml CCl4,振荡、静置、观察Cl4溶液 |
(1)完成该实验需用到的仪器是______
(2)CCl4在实验中所起的作用是______
(3)在实验②中四氯化碳层颜色变化过程为______
(4)该同学的实验缺陷是,改进的办法是______ 查看习题详情和答案>>
实验探究是体验知识的产生或形成过程的基本途径。下面是某同学探究实验报告的一部分,请填空:
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳、淀粉碘化钾试纸
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳、淀粉碘化钾试纸
(1)完成该实验需用到的仪器是____________;
(2)CCl4在实验中所起的作用是____________;
(3)在实验②中四氯化碳层颜色变化过程为____________;
(4)该同学的实验缺陷是__________________,改进的方法是____________________________________.
查看习题详情和答案>>
(2)CCl4在实验中所起的作用是____________;
(3)在实验②中四氯化碳层颜色变化过程为____________;
(4)该同学的实验缺陷是__________________,改进的方法是____________________________________.
某化学兴趣小组为探究
铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整.
(2)实验中他们取6.4g铜片和12ml 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①请写铜跟浓硫酸反应的化学方程式:______.
②为什么有一定量的余酸但未能使用铜片完全溶解,你认为原因是:______.
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是______(填写字母编号).
A、铁粉 B、BaCl2溶液 C、银粉 D、Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两同学进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度.他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______ (填写字母编号).
A、将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B、将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C、用排水法测定装置A产生气体的体积(已折算成标准状况)
D、用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
②乙同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,用标准氢氧化钠溶液进行滴淀(已知:Cu(OH)2开始沉淀的pH约为5),能否通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度______(填“能”或“否”),其理由是______.
查看习题详情和答案>>
铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整.
(2)实验中他们取6.4g铜片和12ml 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①请写铜跟浓硫酸反应的化学方程式:______.
②为什么有一定量的余酸但未能使用铜片完全溶解,你认为原因是:______.
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是______(填写字母编号).
A、铁粉 B、BaCl2溶液 C、银粉 D、Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两同学进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度.他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______ (填写字母编号).
A、将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B、将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C、用排水法测定装置A产生气体的体积(已折算成标准状况)
D、用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
②乙同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,用标准氢氧化钠溶液进行滴淀(已知:Cu(OH)2开始沉淀的pH约为5),能否通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度______(填“能”或“否”),其理由是______.

某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
在上述条件下反应能够自发进行,则反应的△H 0(“>”、“<”、“=”).前2h内的平均反应速率v(N2)= ,在该温度下,反应的平衡常数K= .据此你认为将该反应从理论转化为现实的最重要的研究方向是 .
查看习题详情和答案>>

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 1 | 2 | 3 | 4 | 5 | |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(2011?安庆三模)某校的几名“环保小卫士”在学习了有关水果湖的知识后,利用回收来的废旧干电池进行电池内部主要成分的探究、验证实验.
【查阅资料】经过查阅相关资料得知一般锌锰干电池内部的物质有:二氧化锰、氯化铵、炭黑和淀粉等物质.而且还获知淀粉不溶于冷水,能透过滤纸,它可以用一种“渗析”的方法使之与溶液分离,在热水中淀粉颗粒会膨胀破裂,形成淀粉糊.
【设计实验】
步骤一:拆卸废电池,并将其内部混合物溶于适量的水中.
步骤二:过滤除去不溶物得滤液.
步骤三:
步骤四:适度蒸发浓缩溶液.
步骤五:灼烧滤渣.
【验证和结论】
(1)灼烧滤渣时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中存在炭黑.
(2)向装有H2O2的试管中加入灼烧后的滤渣,迅速产生能使带火星的木条复燃的气体,据此可初步认定滤渣中含有MnO2.H2O2分子中含有
(3)取少量由步骤四得到的溶液于试管中,向其中加入适量的NaOH溶液,加热,产生一种能使湿润的红色石蕊试纸变蓝的气体,由此说明溶液中含有
(4)取少量溶液于试管中,加入
写出反应的离子方程式
【反思与评价】
(1)有的同学认为【验证和结论】中的(1)和(2)既不能确定其中有炭黑也不能确定其中有MnO2,你的观点是
(2)有的同学认为可以不需步骤三而直接将滤液进行蒸发浓缩也可以,你的观点是
(3)有的同学认为可以将步骤四进行深度蒸发可以得到由【验证和结论】(3)和(4)中验证的两种离子形成的晶体.你的观点是
查看习题详情和答案>>
【查阅资料】经过查阅相关资料得知一般锌锰干电池内部的物质有:二氧化锰、氯化铵、炭黑和淀粉等物质.而且还获知淀粉不溶于冷水,能透过滤纸,它可以用一种“渗析”的方法使之与溶液分离,在热水中淀粉颗粒会膨胀破裂,形成淀粉糊.
【设计实验】
步骤一:拆卸废电池,并将其内部混合物溶于适量的水中.
步骤二:过滤除去不溶物得滤液.
步骤三:
将滤液用“渗析”法除去淀粉
将滤液用“渗析”法除去淀粉
.步骤四:适度蒸发浓缩溶液.
步骤五:灼烧滤渣.
【验证和结论】
(1)灼烧滤渣时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中存在炭黑.
(2)向装有H2O2的试管中加入灼烧后的滤渣,迅速产生能使带火星的木条复燃的气体,据此可初步认定滤渣中含有MnO2.H2O2分子中含有
3
3
个σ键,0
0
个π键.(3)取少量由步骤四得到的溶液于试管中,向其中加入适量的NaOH溶液,加热,产生一种能使湿润的红色石蕊试纸变蓝的气体,由此说明溶液中含有
NH4+
NH4+
(填离子化学式).(4)取少量溶液于试管中,加入
稀HNO3
稀HNO3
和AgNO3
AgNO3
有白色沉淀出现,说明溶液中含有Cl-
Cl-
(填离子化学式).写出反应的离子方程式
Ag++Cl-=AgCl↓
Ag++Cl-=AgCl↓
.【反思与评价】
(1)有的同学认为【验证和结论】中的(1)和(2)既不能确定其中有炭黑也不能确定其中有MnO2,你的观点是
赞同
赞同
(填“赞同”或“不赞同”).(2)有的同学认为可以不需步骤三而直接将滤液进行蒸发浓缩也可以,你的观点是
不赞同
不赞同
(填“赞同”或“不赞同”),理由是水中的淀粉颗粒受热会膨胀破裂,形成淀粉糊
水中的淀粉颗粒受热会膨胀破裂,形成淀粉糊
.(3)有的同学认为可以将步骤四进行深度蒸发可以得到由【验证和结论】(3)和(4)中验证的两种离子形成的晶体.你的观点是
不赞同
不赞同
(填“赞同”或“不赞同”),理由是NH4Cl受热分解
NH4Cl受热分解
.