摘要: 在3NO2 + H2O == 2HNO3 + NO的反应中.NO2( ) A.是还原剂 B.既是氧化剂又是还原剂 C.是氧化剂 D.既不是氧化剂又不是还原剂
网址:http://m.1010jiajiao.com/timu3_id_401558[举报]
工业上用反应3NO2+H2O 2HNO3+NO生产硝酸,用NaOH溶液吸收硝酸厂排出的尾气中的NO和NO2气体。已知NO、NO2与NaOH溶液反应的化学方程式为:
2NaOH+NO+NO2 2NaNO2+H2O
2NaOH+2NO2 NaNO2+NaNO3+H2O
(1)在尾气中,NO占混合气体的体积分数为a%,NO2占混合气体的体积分数为b%。若尾气经过足量的NaOH溶液时,NO和NO2能被完全吸收,则a和b的关系是 。
(2)目前有一种治理NO污染的方法是在400℃左右,在催化剂存在的条件下,用氨还原NO,生成两种无害的物质,试写出反应的化学方程式 。
(3)用方法(2)同样可处理NO2气体,在同温同压下,每消耗1体积NH3可处理 体积NO2。
查看习题详情和答案>>(2013?北京)NOx是汽车尾气中的主要污染物之一.
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①写出该反应的热化学方程式:
②随温度升高,该反应化学平衡常数的变化趋势是:
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式:
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐.其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO.原因是:
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
查看习题详情和答案>>
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①写出该反应的热化学方程式:
N2(g)+O2(g)=2NO(g)△H=+183kJ?moL-1
N2(g)+O2(g)=2NO(g)△H=+183kJ?moL-1
.②随温度升高,该反应化学平衡常数的变化趋势是:
增大
增大
.(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式:
2CO+2NO
N2+2CO2
| ||
2CO+2NO
N2+2CO2
.
| ||
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐.其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO.原因是:
根据Mg、Ca、Sr和Ba的质子数,得知它们均为ⅡA族元素.同一主族的元素,从上到下,原子半径逐渐增大
根据Mg、Ca、Sr和Ba的质子数,得知它们均为ⅡA族元素.同一主族的元素,从上到下,原子半径逐渐增大
,元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强.(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
还原
还原
反应(填“氧化”或“还原”).②写出NiO电极的电极反应式:
NO+O2--2e-=NO2
NO+O2--2e-=NO2
.(2011?烟台模拟)自然界中氮的循环涉及到地球上生物圈的方方面面.人类进入工业化社会以后,化学合成氮肥的数量迅速上升,对氮的循环和环境影响很大.下图是工业合成氮肥的转化关系:

回答下列问题:
(1)反应①的条件是
(2)实验室制取NH3的一种方法是在生石灰中滴加浓氨水,其原因是
(3)硝酸厂的尾气含有氮的氧化物,直接排放将污染空气.目前科学家探索利用燃料气体中的CH4等将氮的氧化物还原为N2和H2O,反应原理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO2(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则CH4直接将NO2还原为N2的热化学方程式为
(4)下图表示某温度时,反应N2O4(g) 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进

①此反应的平衡常数表达式K=
.
②反应进行到70s时,改变的条件可能是
A.加入催化剂 B.扩大容器体积 C.升高温度 D.增大N2O4的浓度
③请在图中画出反应物N2O4在0~70秒时的浓度变化曲线.
查看习题详情和答案>>

回答下列问题:
(1)反应①的条件是
高温、高压、催化剂
高温、高压、催化剂
,反应④的化学方程式为3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
,反应⑤所得产物的溶液中离子浓度由大到小得顾序为C(NO3-)>C(NH4+)>C(H+)>C(OH-)
C(NO3-)>C(NH4+)>C(H+)>C(OH-)
.(2)实验室制取NH3的一种方法是在生石灰中滴加浓氨水,其原因是
氧化钙与氨水中的反应生氢氧化钙,使氨水的浓度氢氧根浓度均增大,同时溶液温度升高,共同导致平衡NH3+H2O?NH3?H20?NH4++OH-向左移生成氨气
氧化钙与氨水中的反应生氢氧化钙,使氨水的浓度氢氧根浓度均增大,同时溶液温度升高,共同导致平衡NH3+H2O?NH3?H20?NH4++OH-向左移生成氨气
.(3)硝酸厂的尾气含有氮的氧化物,直接排放将污染空气.目前科学家探索利用燃料气体中的CH4等将氮的氧化物还原为N2和H2O,反应原理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO2(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则CH4直接将NO2还原为N2的热化学方程式为
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
.(4)下图表示某温度时,反应N2O4(g)
 2NO2(g)在前1l0s内的反应进
2NO2(g)在前1l0s内的反应进
①此反应的平衡常数表达式K=
| [NO2]2 |
| [N2O4] |
| [NO2]2 |
| [N2O4] |
②反应进行到70s时,改变的条件可能是
B
B
(填字母),反应进行到90s时,改变的条件可能是D
D
(填字母)A.加入催化剂 B.扩大容器体积 C.升高温度 D.增大N2O4的浓度
③请在图中画出反应物N2O4在0~70秒时的浓度变化曲线.
合成氨工业对国民经济和社会发展具有重要的意义。合成塔中发生反应为N2 (g) +3H2(g) 2NH3(g)
2NH3(g)
△H<0。
(1)工业生产时,制取氢气的一个反应为CO(g)+H2O(g)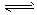 CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。
①T℃时,向1 L密闭容器中充入0.2 mol CO和0.3mol水蒸气,达到平衡后,体系中c(H2)=0.12 mol·L-1。该温度下此反应的平衡常数K=____。
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当重新建立平衡时,水蒸气的总转化率α(H2O)= ________。
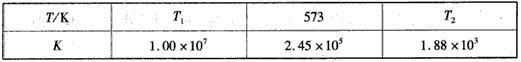
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1____573 K(填“>”、“<”或“=”)。
 2NH3(g)
2NH3(g) △H<0。
(1)工业生产时,制取氢气的一个反应为CO(g)+H2O(g)
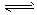 CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。 ①T℃时,向1 L密闭容器中充入0.2 mol CO和0.3mol水蒸气,达到平衡后,体系中c(H2)=0.12 mol·L-1。该温度下此反应的平衡常数K=____。
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当重新建立平衡时,水蒸气的总转化率α(H2O)= ________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1____573 K(填“>”、“<”或“=”)。
(3)673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示,下列有关叙述正确的是___(填序号)。
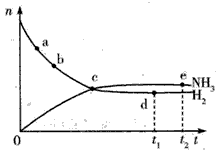
A.c点表示n( NH3)和n(H2)相等
B.c点表示NH3生成的速率与NH3分解的速率相同
C.在e点和d点时,反应的平衡常数相等
D.c点时正反应速率大于逆反应速率
(4)工业上利用NH3制硝酸的过程中有反应:3NO2 +H2O==2HNO3 +NO,从生产流程看,吸收塔中需要补充空气,试分析其原因:___ 。
(5)硝酸厂的尾气中含有氮氧化物,不经处理直接排放会污染空气。目前科学家探索利用气体燃料中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)==4NO(g)+CO2(g) +2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ·mol-1 则甲烷直接将NO2还原为N2的热化学方程式为___。
查看习题详情和答案>>
B.c点表示NH3生成的速率与NH3分解的速率相同
C.在e点和d点时,反应的平衡常数相等
D.c点时正反应速率大于逆反应速率
(4)工业上利用NH3制硝酸的过程中有反应:3NO2 +H2O==2HNO3 +NO,从生产流程看,吸收塔中需要补充空气,试分析其原因:___ 。
(5)硝酸厂的尾气中含有氮氧化物,不经处理直接排放会污染空气。目前科学家探索利用气体燃料中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)==4NO(g)+CO2(g) +2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ·mol-1 则甲烷直接将NO2还原为N2的热化学方程式为___。