摘要:如右图所示:若关闭Ⅱ阀打开Ⅰ阀.让一种含有氯气的气体经过乙瓶后.布条不褪色.若关闭Ⅰ阀.打开Ⅱ阀.再通入这种气体.通入乙瓶 .布条褪色,甲瓶中所盛的试剂可能是 A.浓H2SO4 B.NaOH溶液 C.KI溶液 D.饱和NaCl溶液
网址:http://m.1010jiajiao.com/timu3_id_401456[举报]
如右图所示,当关闭阀门K时,向甲中充入2molSO2和1molO2,在800℃时发生反应:

![]() .1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
.1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
A.在800℃,若向甲的平衡体系中,再充入lmolS03气,达到薪平衡时,SO3的体积分数增大
B.800℃时,乙中反应达到平衡状态时,其气体体积小于1.125L
C若打开阀门K,新的平衡混合气中SO3的体积分数比打开K前甲、乙中的都大
D.800℃时,乙中反应![]() 的平衡常数为24
的平衡常数为24
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )①浓H2SO4 ②NaOH溶液 ③饱和NaCl溶液.
查看习题详情和答案>>
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂不可能是( )
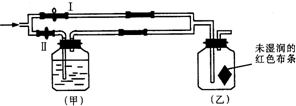

| A、浓H2SO4 | B、NaOH溶液 | C、KI溶液 | D、饱和NaCl溶液 |
 有A、B、C、D、E、M、X七种元素.其相关信息如下:
有A、B、C、D、E、M、X七种元素.其相关信息如下:| 相关信息 | |
| ① | A的基态原子2p轨道中有三个未成对电子 |
| ② | A、B元素的常见单质是构成空气的主要成分 |
| ③ | C是电负性最大的元素 |
| ④ | D是主族元素,基态原子有四个能层,且最外能层上只有两个电子 |
| ⑤ | D、E、M、X四种元素处于同一周期; M与E又位于同一族,M的原子序数比E多1,M的基态原子中含有三个未成对电子; X原子外围电子排布式为3d104s1 |
(1)A元素的电负性与B的电负性相比,电负性较大的是
O
O
(填写元素符号).M的原子序数为27
27
;X元素在周期表中的位置是第四周期第IB族
第四周期第IB族
.(2)A与C组成AC3分子的VSEPR模型为
四面体
四面体
,AB3-离子的空间构型为平面三角形
平面三角形
.(3)画出B元素原子的核外电子排布图
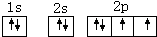

1s22s22p63s23p63d5
1s22s22p63s23p63d5
.;(4)E、X晶体晶体的堆积模型依次为体心立方堆积、面心立方最紧密堆积,其配位数依次为
8、12
8、12
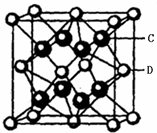
.(5)C与D可形成离子化合物,其晶胞结构如右图所示.若该晶胞的边长为500.0pm.若该晶体的密度为
4.15
4.15
g/cm3(列式并计算).