摘要:化学反应中能量变化的主要原因:化学键的断裂和形成.
网址:http://m.1010jiajiao.com/timu3_id_40089[举报]
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ·mol-1表示。请认真观察下图,然后回答问题。
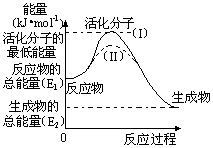
(1)图中反应是________(填“吸热”或“放热”)反应,该反应的△H=________(用含E1、E2的代数式表示)
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为
167.2kJ·mol-1,则其逆反应的活化能为________。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是______________________。
(4)已知C(石墨 s)的燃烧热为393.5kJ/mol,C(金刚石 s)的燃烧热为395.0kJ/mol
①写出表示石墨燃烧热的热化学方程式:____________________________
②写出石墨转化成金刚石的热化学方程式:____________________________
③根据②有同学认为该反应很容易进行,但事实上该反应却很难发生,需要很高的温度和很高的压强,请你分析造成这种原因的主要因素是______________________________
查看习题详情和答案>>
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为
167.2kJ·mol-1,则其逆反应的活化能为________。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是______________________。
(4)已知C(石墨 s)的燃烧热为393.5kJ/mol,C(金刚石 s)的燃烧热为395.0kJ/mol
①写出表示石墨燃烧热的热化学方程式:____________________________
②写出石墨转化成金刚石的热化学方程式:____________________________
③根据②有同学认为该反应很容易进行,但事实上该反应却很难发生,需要很高的温度和很高的压强,请你分析造成这种原因的主要因素是______________________________
[化学-选修化学与技术]金属钛(Tl)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.常温下,钛的化学活性很小,仅能与氧气、氢氟酸等几种物质起反应.但在较高温度下,钛可与多种单质和化合物发生反应.以钛铁矿(主要成分FeTlO2,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
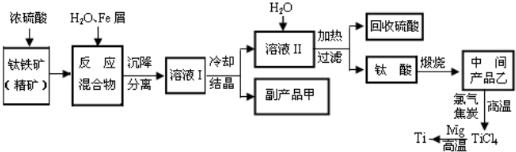
请回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TlOSO4,无气体生成,副产品甲是 .
(2)上述生产流程中加入Fe的目的是 ,检验副产品甲是否变质的实验方法是 .
(3)上述生产流程中所得一的金属钛中混有少量杂质,可加入 溶解后除去.
(4)科学家从电解冶炼铝的工艺得到启发,找到了冶炼钛的新工艺,它可以用熔融法直接电解中间产品乙制取金属法.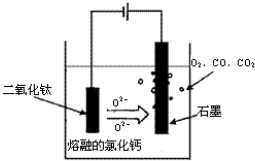
①直接电解法(剑桥法)生产钛是种较先进的方法,电解质为熔融的氧化钙,原理如图所示;在阴极,被还原的Ca进一步还原TlO2获得钛,可能发生的反应或电极反应为 .
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两 极产物隔开,只允许氧离子通过,在电解过程中阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体若是单质,可以是 ,则阳极发生的电极反应式为 .
查看习题详情和答案>>

请回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TlOSO4,无气体生成,副产品甲是
(2)上述生产流程中加入Fe的目的是
(3)上述生产流程中所得一的金属钛中混有少量杂质,可加入
(4)科学家从电解冶炼铝的工艺得到启发,找到了冶炼钛的新工艺,它可以用熔融法直接电解中间产品乙制取金属法.

①直接电解法(剑桥法)生产钛是种较先进的方法,电解质为熔融的氧化钙,原理如图所示;在阴极,被还原的Ca进一步还原TlO2获得钛,可能发生的反应或电极反应为
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两 极产物隔开,只允许氧离子通过,在电解过程中阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体若是单质,可以是
味精的主要成分是谷氨酸一钠盐( ),可用淀粉发酵法生产.
),可用淀粉发酵法生产.
(1)发酵法第一步是使淀粉水解.实验室中淀粉在酸性条件下水解为单糖的化学方程式是
a.NaOH溶液、氨水、AgNO3溶液 b.H2SO4溶液、碘水
c.NaOH溶液、CuSO4溶液 d.H2SO4溶液、CuSO4溶液
(2)测定味精中谷氨酸一钠盐的含量:将一定质量味精样品溶于水,向所得溶液中加入甲醛溶液(发生反应:-NH2+HCHO→-N=CH2+H2O),再以酚酞为指示剂,用NaOH溶液进行滴定.上述测定过程中加入甲醛的目的是
(3)味精中常含食盐,现设计方案测定味精中NaCl的含量(味精中的其他成分和指示剂的用量对测定结果无影响):取m g味精溶于水,加入过量c1mol?L-1 AgNO3溶液,再加入少量含Fe3+的溶液作指示剂,用c2 mol?L-1 NH4SCN溶液进行滴定(AgSCN为白色难溶物),溶液最终变为红色时,达到滴定终点.重复上述测定过程3次,测得消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1 mL和V2 mL.
①用上述方法测得该味精样品中NaCl的质量分数是
%
%.
②若实验操作无误差,测定结果低于实际值.用平衡移动原理解释结果偏低的可能原因是
查看习题详情和答案>>
 ),可用淀粉发酵法生产.
),可用淀粉发酵法生产.(1)发酵法第一步是使淀粉水解.实验室中淀粉在酸性条件下水解为单糖的化学方程式是
(C6H10O5)n+nH2O
nC6H12O6
| 酸 |
(C6H10O5)n+nH2O
nC6H12O6
;可检验淀粉已经发生水解的试剂组合是| 酸 |
ac
ac
(填序号).a.NaOH溶液、氨水、AgNO3溶液 b.H2SO4溶液、碘水
c.NaOH溶液、CuSO4溶液 d.H2SO4溶液、CuSO4溶液
(2)测定味精中谷氨酸一钠盐的含量:将一定质量味精样品溶于水,向所得溶液中加入甲醛溶液(发生反应:-NH2+HCHO→-N=CH2+H2O),再以酚酞为指示剂,用NaOH溶液进行滴定.上述测定过程中加入甲醛的目的是
避免显碱性的氨基影响羧基和NaOH的中和反应
避免显碱性的氨基影响羧基和NaOH的中和反应
.(3)味精中常含食盐,现设计方案测定味精中NaCl的含量(味精中的其他成分和指示剂的用量对测定结果无影响):取m g味精溶于水,加入过量c1mol?L-1 AgNO3溶液,再加入少量含Fe3+的溶液作指示剂,用c2 mol?L-1 NH4SCN溶液进行滴定(AgSCN为白色难溶物),溶液最终变为红色时,达到滴定终点.重复上述测定过程3次,测得消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1 mL和V2 mL.
①用上述方法测得该味精样品中NaCl的质量分数是
| 5.85(c1V1-c2V2) |
| m |
| 5.85(c1V1-c2V2) |
| m |
②若实验操作无误差,测定结果低于实际值.用平衡移动原理解释结果偏低的可能原因是
AgCl在溶液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),加入NH4SCN溶液后,SCN-与Ag+结合生成更难溶的AgSCN沉淀,使AgCl的溶解平衡向右移动,NH4SCN消耗量增大
AgCl在溶液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),加入NH4SCN溶液后,SCN-与Ag+结合生成更难溶的AgSCN沉淀,使AgCl的溶解平衡向右移动,NH4SCN消耗量增大
.(10分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
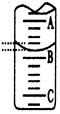
(2)下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。

(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L。 查看习题详情和答案>>
(9分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
| A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积 |
| B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液 |
| C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗 |
| D.锥形瓶预先用食用白醋润洗过 |
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L。 查看习题详情和答案>>