网址:http://m.1010jiajiao.com/timu3_id_400869[举报]
(A)“物质结构与性质”课程模块
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是___________ (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是________;③和⑦形成的常见化合物的化学键类型是___________。
(3)元素⑧的外围电子排布式为___________,该元素原子中未成对电子数为___________。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_________________________________________________。
(5)在1 183 K以下,元素⑨形成如图甲所示基本结构单元的晶体;1 183 K以上,转变为图乙所示基本结构单元的晶体。

在1 183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为___________;在1 183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为___________。
(B)“实验化学”课程模块
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:

氧化型(蓝色)+ne-![]() 还原型(无色)。
还原型(无色)。
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图甲。
某校化学兴趣小组用图甲装置进行下述实验:
①在250 mL锥形瓶中,依次加入
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③④可重复多次。
请回答下列问题:
(1)若塞紧图甲中锥形瓶塞,并打开导管活塞a、b,从___________(填“左”或“右”)导管口通入足量氦气后,再关闭活塞a、b并振荡,溶液__________(填“能”或“不能”)由无色变为蓝色。
(2)如图乙所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是___________试管。
(3)上述转化过程中葡萄糖的作用是_______________,亚甲基蓝的作用是______________。
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为______________。
(5)该实验中③④操作___________(填“能”或“不能”)无限次重复进行,理由是____________。
查看习题详情和答案>>下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是 ;
③和⑦形成的常见化合物的化学键类型是 。
(3)元素⑧的外围电子排布式为 ,该元素原子中未成对电子数为 。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
(5)在1183 K以下,元素⑨形成如图1所示基本结构单元的晶体;1183 K以上,转变 为图2所示基本结构单元的晶体。


在1183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为 ;
在1183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为 。
(B).
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:
![]()
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。


某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液 (填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是 试管。
(3)上述转化过程中葡萄糖的作用是 ,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为 。
(5)该实验中③、④操作 (填“能”或“不能”)无限次重复进行,理由是 。
查看习题详情和答案>>下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于ds区的元素是 (填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是 ;
③和⑦形成的常见化合物的化学键类型是 。
(3)元素⑧的外围电子排布式为 ,该元素原子中未成对电子数为 。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
(5)在1183 K以下,元素⑨形成如图1所示基本结构单元的晶体;1183 K以上,转变 为图2所示基本结构单元的晶体。


在1183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为 ;
在1183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为 。
(B).
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:

奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。


某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液 (填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是 试管。
(3)上述转化过程中葡萄糖的作用是 ,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为 。
(5)该实验中③、④操作 (填“能”或“不能”)无限次重复进行,理由是 。
石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如右图所示,图中用虚线标出了石墨的一个六方晶胞。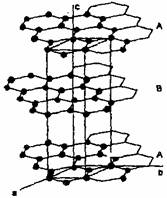
(1)该晶胞的碳原子个数 。
(2)写出晶胞内各碳的原子坐标。
(3)已知石墨的层间距为334.8 pm,C-C键长为142 pm,计算石墨晶体的密度为 。
 石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+x Li++x e-→ LiC6 其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
(4)右图给出了一个Li+沿C轴投影在A层上的位置,试在右图上标出与该离子临近的其他6个Li+的投影位置。
(5)在LiC6中,Li+与相邻石墨六元环的作用力属何种键型?
(6)某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式。
锂离子电池的正极材料为层状结构的LiNiO2。已知LiNiO2中Li+和Ni3+均处于氧离子组成的正八面体体心位置,但处于不同层中。
(7)将化学计量的NiO和LiOH在空气中加热到770℃可得LiNiO2,试写出反应方程式。
(8)写出LiNiO2正极的充电反应方程式。
(9)锂离子完全脱嵌时 LiNiO2 的层状结构会变得不稳定,用铝取代部分镍形成LiNi1-y Al y O2。可防止理离子完全脱嵌而起到稳定结构的作用,为什么?
查看习题详情和答案>>图表法、图象法是常用的科学研究方法。
I.短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第 族。
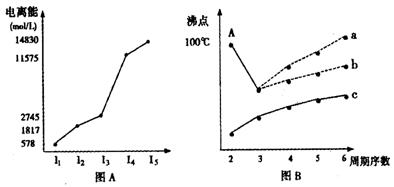
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是: ,理由是:
。
CH4、NH3、H2O、HF四种氢化物的沸点从高到低的顺序: > > > 。
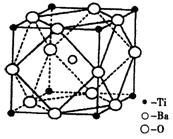
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的外围电子排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,是很好的压电材料。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 ;每个氧离子周围的钛离子的配位数为 ,每个钡离子周围的氧离子配位数位为 。