网址:http://m.1010jiajiao.com/timu3_id_400829[举报]
(1)在精炼铜时,阳极减小的质量与阴极增加的质量是否相等______(填“是”或“否”);阳极下面沉积金属的成分主要是______.
(2)在精炼铜的过程中,Cu2+浓度逐渐下降,c(Fe2+)、c(Zn2+)会逐渐______,所以需要定时除去其中的Fe2+、Zn2+.甲同学设计了下列除杂方案I(见下图).

请参照下表给出的数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | Zn(OH)2 |
| 开始沉淀时的pH | 7.6 | 5.2 | 2.7 | 8.0 |
| 完全沉淀时的pH | 9.6 | 6.7 | 3.7 | 11.0 |
②操作①调节pH至b,b的取值范围是______.
③调节溶液A的PH时可选择下列哪些试剂______.
A.NaOH B.CuO C.Cu(OH)2 D.NH3?H2O E.Cu2(OH)2CO3
④操作②是______,方案I中不能够除去的杂质金属阳离子是______.
(3)乙同学在查阅课本时发现,“工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7-8,可使Fe3+生成
Fe(OH)3沉淀而除去.”乙同学认为甲同学的方案I中也应该将溶液pH调至7-8.你认为乙同学的建议是否正确?______(填“是”或“否”)理由是______.
查看习题详情和答案>>
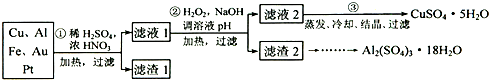
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为
| ||
或3Cu+8H++2NO3-
| ||
| ||
或3Cu+8H++2NO3-
| ||
(2)第②步加H2O2的作用是
(3)用第③步所得CuSO4?5H2O制备无水CuSO4的方法是
(4)由滤渣2制取Al2(SO4)3?18H2O,探究小组设计了三种方案:
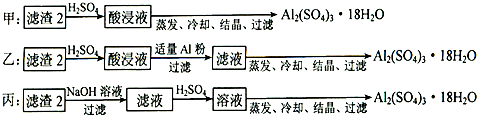
上述三种方案中,
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程式为___________________________________;
⑵ 第②步加H2O2的作用是把Fe2+氧化为Fe3+,使用H2O2的优点是___________________;
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是____________________________(填仪器名称和操作方法)。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,______方案不可行,从原子利用率角度考虑,_______方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol· L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
在往滴定管中装入标准液之前,滴定管应该先经过 ,再用水清洗干净,
然后再 ,方可装入标准液。排除酸式滴定管尖嘴处气泡的方法是 。在滴定时, 手操作滴定管活塞。
(6)写出计算CuSO4·5H2O质量分数的表达式(要求带单位)ω= _____________ ;
(7)下列操作会导致CuSO4·5H2O含量的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡 ks5u
c.未除净可与EDTA反应的干扰离子
d.读取滴定管中待测液的初始体积时仰视
查看习题详情和答案>>
