摘要:29.如图I.在恒压密闭容器M中加入2 mol A和2 mol B.起始时容器体积为VL.发生如下反应并达到化学平衡状态:2 A X C(g),△H<O平衡时A.B.C的物质的量之比为l∶3∶4.C的物质的量为y mol. (1)根据题中数据计算.x= .Y= , (2)如图Ⅱ.在体积为V L的恒容密闭容器N中发生上述反应.测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡).平衡时容器中C的物质的量为z mol.由于反应物A.B的状态未知.则z和y的大小也不确定.请在下表中填入A.B的状态与z.y的大小之间的关系: 可能的 情形 A.B是否为气态 z与y的大小关系 M的大小关系 A B ① 是 不是 z=Y 无法确定 ② ③
网址:http://m.1010jiajiao.com/timu3_id_400249[举报]
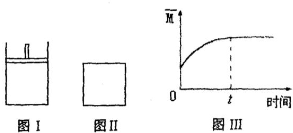
如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。 当其他条件相同时,在Ⅰ、Ⅱ 中分别加入
2 mol X和2 mol Y,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+Y(?)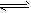 aZ(g)(提示:物质X、Y的状态均未知,物质Z的状态为气态)。此时I中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)(提示:物质X、Y的状态均未知,物质Z的状态为气态)。此时I中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是
2 mol X和2 mol Y,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+Y(?)
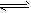 aZ(g)(提示:物质X、Y的状态均未知,物质Z的状态为气态)。此时I中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是
aZ(g)(提示:物质X、Y的状态均未知,物质Z的状态为气态)。此时I中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是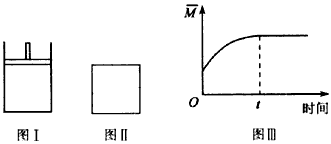
[ ]
A.物质Z的化学汁量数a=2
B.若Ⅱ中混合气体的平均相对分子质量(M)如图Ⅲ所示,则X、Y两种物质可能均为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
查看习题详情和答案>>
B.若Ⅱ中混合气体的平均相对分子质量(M)如图Ⅲ所示,则X、Y两种物质可能均为气态
C.若X、Y均为气态,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
(2011?天津模拟)如图所示,图I是恒压密闭容器,图II是恒容密闭容器.当其它条件相同时,在Ⅰ、Ⅱ分别加入2mol X和2mol Y,开始时容器的体积均为VL,发生如下反应并达到平衡状态:2X(?)+Y(?)?aZ(g)(提示:物质X、Y的状态均未知,物质Z的状态为气态.)此时I中X、Y、Z的物质的量之比为1:3:2.下列判断正确的是( )

在如图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为常见金属,且I与G的稀溶液不反应,只能与G的浓溶液在加热条件下反应;H可制作耐火材料(图中部分产物没有列出).回答下列问题:
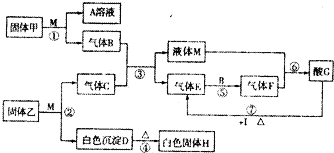
(I)固体甲的电子式为, ;固体乙与M反应的化学方程式为
(2)反应①一⑦中属于氧化还原反应的是 (填写反应序号).
(3)工业上常采用浓氨水吸收废气中的气体E,通过处理既可以制得化肥又可以获得较纯的E而循环利用,写出用过量的浓氨水吸收E的化学方程式:
(4)用惰性电极电解I与G反应所得的盐溶液200mL,需要加入0.8g I的氧化物才能将溶液恢复原状,则阴极上通过的电子数是 ,如果忽略溶液体积变化,电解后所得溶液的pH=
(5)模拟工业上催化氧化E,450℃在一个恒压密闭容器中充入2mol E和1mol B达到平衡后测得F的体积分数为80%,放出热量60kJ,该条件下反应的热化学方程式为 .
查看习题详情和答案>>

(I)固体甲的电子式为,
(2)反应①一⑦中属于氧化还原反应的是
(3)工业上常采用浓氨水吸收废气中的气体E,通过处理既可以制得化肥又可以获得较纯的E而循环利用,写出用过量的浓氨水吸收E的化学方程式:
(4)用惰性电极电解I与G反应所得的盐溶液200mL,需要加入0.8g I的氧化物才能将溶液恢复原状,则阴极上通过的电子数是
(5)模拟工业上催化氧化E,450℃在一个恒压密闭容器中充入2mol E和1mol B达到平衡后测得F的体积分数为80%,放出热量60kJ,该条件下反应的热化学方程式为