网址:http://m.1010jiajiao.com/timu3_id_399909[举报]

2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题:
保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a=1mol,c=2mol,则b=______ mol,在此情况下,反应起始时将向______方向进行(填“正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的取值范围是______.
(3)在上述装置中,若需控制平衡后混和气体的物质的量为6.5mol,则可采取的措施是______
Ⅱ.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2mol SO2和1mol O2,在B中充入2mol SO3和 1mol N2,在相同条件下发生可逆反应:2SO2(g)+O2(g)

2SO3(g).根据下列要求填写空白:
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA与PB的关系是PA______PB(填“<”、“=”、“>”).

(2)若要使A与B中平衡状态相同,可移动活塞的位置应在______处.
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x和y 的关系是
x______y.(填“<”、“=”、“>”).
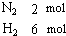
 2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题:
2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a=1mol,c=2mol,则b=______ mol,在此情况下,反应起始时将向______方向进行(填“正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的取值范围是______.
(3)在上述装置中,若需控制平衡后混和气体的物质的量为6.5mol,则可采取的措施是______
Ⅱ.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2mol SO2和1mol O2,在B中充入2mol SO3和 1mol N2,在相同条件下发生可逆反应:2SO2(g)+O2(g)
 2SO3(g).根据下列要求填写空白:
2SO3(g).根据下列要求填写空白:(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA与PB的关系是PA______PB(填“<”、“=”、“>”).
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在______处.
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x和y 的关系是
x______y.(填“<”、“=”、“>”).

 查看习题详情和答案>>
查看习题详情和答案>>
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g)2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0、86×10-4 | 2、6×10-4 | 64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
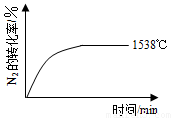
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H22NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(4)合成氨的反应N2(g)+3H2(g)2NH3(g) △H =-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”),可推断a 0、01(填大于、等于或小于)。
查看习题详情和答案>>
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0、86×10-4 |
2、6×10-4 |
64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2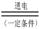 2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入
极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
 (4)合成氨的反应N2(g)+3H2(g)
(4)合成氨的反应N2(g)+3H2(g)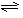 2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H =
-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”), 可推断a 0、01(填大于、等于或小于)。
查看习题详情和答案>>
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)在不同温度下,反应N2(g)+O2(g)![]() 2NO(g) ΔH=a kJ·mol-1
2NO(g) ΔH=a kJ·mol-1
![]()
①该反应的ΔH________0
(填“>”、“=”或“<”).②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃时N2的转化率随时间变化的示意图.
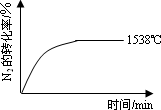
(2)
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.相应的热化学方程式如下:2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ΔH=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热ΔH=________.(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2 2NH3.则在电解法合成氨的过程中,
2NH3.则在电解法合成氨的过程中,
(4)合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填字母代号).
2NH3(g) ΔH=-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填字母代号).
a、升高温度
b、加入催化剂
c、增加H2的浓度
d、增加N2的浓度
e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”),可推断a________0.01(填大于、等于或小于).