摘要:有甲.乙.丙.丁.戊5种无色溶液.它们是硝酸钙.盐酸.硝酸银.碳酸钠和氯化钡的水溶液.各取少量进行两两混合试验.结果见表. 表中“- 表示无明显现象.根椐表中现象判断:(已知Ag2CO3为白色的不溶性沉淀) 甲 氯化钡 .乙 硝酸银 .丙 盐酸 . 丁 碳酸钠 .戊 硝酸钙 .
网址:http://m.1010jiajiao.com/timu3_id_3998701[举报]
甲、乙、丙、丁、戊均是由前20号元素组成的常见物质,根据有关信息回答下列问题:
(1)无色气体甲由非极性分子构成,且甲分子内只有1对共用电子对,甲的分子式为____________;
(2)若乙是含有非极性单键的离子化合物,且乙的焰色反应呈黄色,则乙的电子式为____________;若乙是含有非极性三键的离子化合物,则乙的电子式为______________;
(3)丙可以由两种常见气体化合生成,丙受热分解时破坏了共价键和离子键,却只形成共价键,写出丙溶于水时发生反应的离子方程式_________________________;
(4)单质丁是重要的半导体材料,丁的氧化物的晶体类型是___________,写出工业制备丁的化学反应方程式_____________________;
(5)戊(W3Q4)是由元素W、Q形成的结构陶瓷材料,戊的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和戊。上述相关反应的化学方程式(各物质用化学式表示)是__________________。
查看习题详情和答案>>
(1)无色气体甲由非极性分子构成,且甲分子内只有1对共用电子对,甲的分子式为____________;
(2)若乙是含有非极性单键的离子化合物,且乙的焰色反应呈黄色,则乙的电子式为____________;若乙是含有非极性三键的离子化合物,则乙的电子式为______________;
(3)丙可以由两种常见气体化合生成,丙受热分解时破坏了共价键和离子键,却只形成共价键,写出丙溶于水时发生反应的离子方程式_________________________;
(4)单质丁是重要的半导体材料,丁的氧化物的晶体类型是___________,写出工业制备丁的化学反应方程式_____________________;
(5)戊(W3Q4)是由元素W、Q形成的结构陶瓷材料,戊的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和戊。上述相关反应的化学方程式(各物质用化学式表示)是__________________。
A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族.A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2-离子含10个电子.
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式: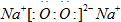
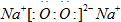 .
.
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式: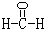
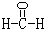 .
.
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
查看习题详情和答案>>
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式:
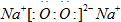
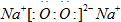
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式:
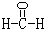
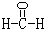
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
C2H2(g)+
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol
| 1 |
| 2 |
C2H2(g)+
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol
.| 1 |
| 2 |
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
C2H2-10e-+14OH-=2CO32-+8H2O
C2H2-10e-+14OH-=2CO32-+8H2O
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
.(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
2I-+H2O2+2H+=I2+2H2O
2I-+H2O2+2H+=I2+2H2O
.(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
.A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族。A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C―2离子含10个电子。
(1)工业制取D单质的反应方程式是 。
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应。甲的一种用途是 。由甲中的两种元素组成,且与甲等电子的物质的分子式是 。
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,乙的电子式是 。已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是 。
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应方程式是 。(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是 。
查看习题详情和答案>>
A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族.A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2-离子含10个电子.
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式:______.
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式:______.
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:______.
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
______
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:______.
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是______.
(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:______.
查看习题详情和答案>>
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式:______.
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式:______.
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:______.
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
______
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:______.
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是______.
(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:______.
查看习题详情和答案>>
已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol 丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件已略去).
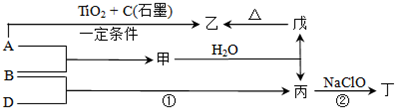
请回答:
(1)单质B的组成元素在周期表中的位置是
(2)丁中所包含的化学键类型有
a.离子键 b.极性共价键 c.非极性共价键
(3)反应①的化学方程式为
(4)反应②中,0.5mol NaClO参加反应时,转移1mol电子,其化学方程式为
(5)-定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为
查看习题详情和答案>>

请回答:
(1)单质B的组成元素在周期表中的位置是
第2周期第ⅤA族
第2周期第ⅤA族
.(2)丁中所包含的化学键类型有
bc
bc
(填字母序号).a.离子键 b.极性共价键 c.非极性共价键
(3)反应①的化学方程式为
N2+3H2
2NH3
| 催化剂 |
| 高温高压 |
N2+3H2
2NH3
.| 催化剂 |
| 高温高压 |
(4)反应②中,0.5mol NaClO参加反应时,转移1mol电子,其化学方程式为
2NH3+NaClO═N2H4+NaCl+H2O
2NH3+NaClO═N2H4+NaCl+H2O
.(5)-定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为
4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
.