网址:http://m.1010jiajiao.com/timu3_id_399461[举报]
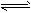 2CO(g) (正反应吸热),升高温度会加快化学反应速率
2CO(g) (正反应吸热),升高温度会加快化学反应速率B.合成氨反应中,当3v(NH3)正=2v(H2)逆时,反应达到平衡
C.对于反应PCl5(g)
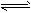 PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小
PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小 D.将n molH2(g).n molI2(g)和2n molH2(g).2n molI2(g)分别充入两个等温等容的容器中,平衡时H2的转化率前者小于后者
| A.对于反应C(s)+CO2 (g)=2CO(g)△H>0,升高温度会加快化学反应速率 |
| B.将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| C.合成氨反应中,当3v(NH3)正=2v(H2)逆时,反应达到平衡 |
| D.对于反应PCl5(g)?PCl3(g)+Cl2(g),达到平衡后,若保持温度容积不变,又加入一定量的PCl5,则该平衡向正方向移动,但平衡时PCl5的转化率减小 |
途径I: C(s)+O2(g) === CO2(g)
途径II:
先制水煤气:C(s) + H2O(g) === CO(g) + H2(g)
燃烧水煤气:2CO(g) + O2(g) === 2CO2(g);2H2(g)+O2(g) ===2H2O(g)
已知:
①C(s)+O2(g)===CO2(g);△H1=-393.5 kJ/mol
②H2(g)+ 1/2O2(g)=H2O(g);△H2=-241.8kJ/mol
③CO(g)+ 1/2O2(g) =CO2(g);△H3=-283.0kJ/mol
请回答下列问题:
(1)C(煤)的标准燃烧热是_______________________
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:___________________
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是_________ (单选)
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)=2NO(g)△H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________________。
②在该温度下,反应的平衡常数K = 。(只写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明 (填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
查看习题详情和答案>>