摘要:9.下列说法错误的是 A.pH=0的溶液呈中性 B.盐酸加水稀释时pH增大 C.碱的共性其实是OH-的性质 D.CaO粉末中滴入适量无色酚酞试液变红色
网址:http://m.1010jiajiao.com/timu3_id_3994352[举报]
下列说法错误的是
[ ]
A.等物质的量浓度的醋酸和醋酸钠溶液等体积混合的溶液中一定存在:c( CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+)
B.常温下将pH=10的氨水稀释10倍,溶液中H+离子的物质的量浓度反而增大
C.在NH4Cl与氨水混合呈碱性的溶液中一定存在:c(NH4+)>c(Cl-)
D.将0. 001 mol/L的AgNO3溶液逐滴滴入含0.001 mol/L的KCl和0.001 mol/L 的K2CrO4混合溶液中,先产生Ag2CrO4沉淀[25℃:Ksp( AgCl)=1.8× 10-10 mol2·L-2; Ksp(Ag2CrO4)=1.9×10-12 mol3· L-3]
查看习题详情和答案>>
B.常温下将pH=10的氨水稀释10倍,溶液中H+离子的物质的量浓度反而增大
C.在NH4Cl与氨水混合呈碱性的溶液中一定存在:c(NH4+)>c(Cl-)
D.将0. 001 mol/L的AgNO3溶液逐滴滴入含0.001 mol/L的KCl和0.001 mol/L 的K2CrO4混合溶液中,先产生Ag2CrO4沉淀[25℃:Ksp( AgCl)=1.8× 10-10 mol2·L-2; Ksp(Ag2CrO4)=1.9×10-12 mol3· L-3]
 已知H2B在水溶液中存在以下电离:
已知H2B在水溶液中存在以下电离:一级电离:H2B
 H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2-请回答以下问题:
(1)NaHB溶液
无法确定
无法确定
(填“呈酸性”、“呈碱性”或“无法确定”),原因是NaHB溶液中同时存在HB? H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
 H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性NaHB溶液中同时存在HB? H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
. H++B2-,HB?+H2O
H++B2-,HB?+H2O H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2B+OH?,因两个平衡程度无法确定,故难以确定溶液酸碱性(2)若0.1mol?L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol?L-1,则H2B的一级电离的电离度为
1%
1%
.(3)某温度下,在0.1mol?L-1的NaHB溶液中,以下关系一定不正确的是
C、D
C、D
A.c(H+)?c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol?L-1≥c(B2-)
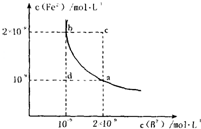
(4)某温度下,FeB(s)
 Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是C、D
C、D
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18.
对于25℃、pH=2的醋酸溶液,下列说法错误的是
| A.加适量水稀释,溶液中c(H+)与c(OH-)的乘积不变 |
| B.加入醋酸钠固体,当溶液呈中性时c(Na+)=c(CH3COO-) |
| C.该溶液中由水电离产生的c(OH-)=1×10-12mol/L |
| D.用0.01mol/L NaOH中和同体积同pH的盐酸和醋酸消耗NaOH体积,V(盐酸)>V(醋酸) |
已知H2B在水溶液中存在以下电离:
一级电离:H2B

H++HB-,二级电离:HB-

H++B2-
请回答以下问题:
(1)NaHB溶液______(填“呈酸性”、“呈碱性”或“无法确定”),原因是______.
(2)若0.1mol-L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol-L-1,则H2B的一级电离的电离度为______.
(3)某温度下,在0.1mol-L-1的NaHB溶液中,以下关系一定不正确的是______
A.c(H+)-c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol-L-1≥c(B2-)
(4)某温度下,FeB(s)

Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)-c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18.
查看习题详情和答案>>
一级电离:H2B

H++HB-,二级电离:HB-

H++B2-
请回答以下问题:
(1)NaHB溶液______(填“呈酸性”、“呈碱性”或“无法确定”),原因是______.
(2)若0.1mol-L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol-L-1,则H2B的一级电离的电离度为______.
(3)某温度下,在0.1mol-L-1的NaHB溶液中,以下关系一定不正确的是______
A.c(H+)-c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol-L-1≥c(B2-)
(4)某温度下,FeB(s)

Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)-c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18.

已知H2B在水溶液中存在以下电离:
一级电离:H2B H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2-
请回答以下问题:
(1)NaHB溶液______(填“呈酸性”、“呈碱性”或“无法确定”),原因是______.
(2)若0.1mol?L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol?L-1,则H2B的一级电离的电离度为______.
(3)某温度下,在0.1mol?L-1的NaHB溶液中,以下关系一定不正确的是______
A.c(H+)?c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol?L-1≥c(B2-)
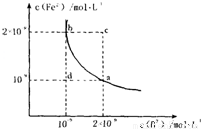
(4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18.
 查看习题详情和答案>>
查看习题详情和答案>>
一级电离:H2B
 H++HB-,二级电离:HB-
H++HB-,二级电离:HB- H++B2-
H++B2-请回答以下问题:
(1)NaHB溶液______(填“呈酸性”、“呈碱性”或“无法确定”),原因是______.
(2)若0.1mol?L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol?L-1,则H2B的一级电离的电离度为______.
(3)某温度下,在0.1mol?L-1的NaHB溶液中,以下关系一定不正确的是______
A.c(H+)?c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol?L-1≥c(B2-)
(4)某温度下,FeB(s)
 Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______
Fe2+(aq)+B2-(aq)的平衡常数表达式为KSP=c(Fe2+)?c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是______A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18.
 查看习题详情和答案>>
查看习题详情和答案>>