网址:http://m.1010jiajiao.com/timu3_id_399368[举报]
(1)写出A、C的元素符号:A_________________;C_________________。
(2)将A、B组成的气态化合物通入D单质的水溶液中,可观察到的现象是______________,写出发生反应的离子方程式,并标出电子转移方向和数目_____________________________。
(3)已知:B的气态氢化物的水溶液与A、B组成的气态化合物的水化物的水溶液均呈酸性。今欲确定这两种酸的酸性强弱,请你设计实验方案。
(4)试证明:B与D何种元素的非金属性更强。请用化学方程式表示你所设计实验的反应原理:____________________________________________________________________。
查看习题详情和答案>>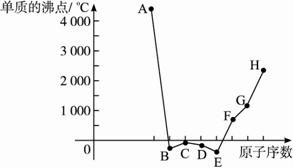
请回答:
(1)上述元素的最高价氧化物的水化物中,碱性最强的是(写化学式)___________;上述元素的气态氢化物中,最稳定的是(写化学式)________________。
(2)上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质的分子式是_______________________________
(3)已知D、F、G三种元素的离子均具有跟Ne相同的电子层结构,则这三种离子的半径由大到小的次序为(用相关元素的离子符号表示):_______________________________________。
查看习题详情和答案>>(1)D元素处于周期表中___________________;
(2)A、D、E三种元素形成的盐(化学式为A9D3E)的水溶液呈____________性,用离子方程式解释其原因__________________;
(3)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1 mol·L-1 W的水溶液的pH为13,Q的水溶液呈酸性,且物质的量浓度相同的W、Q溶液中水的电离程度前者小于后者,则W为___________________,Q为__________________(填化学式)。
(4)用A单质和B单质可制气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池负极的电极反应式:_______________________。
查看习题详情和答案>>
(1)若A、D、F都是非金属单质,常温下,A、D为固体,D单质可作为半导体材料,F为气体,且A、D所含元素为同主族短周期元素,A、F所含元素同周期,则反应①的化学方程式是______________________________。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,C的溶液为浅绿色,则反应②(在水溶液中进行)的离子方程式是:______________________
(3)若B、C、F都是气态单质,B有毒且呈黄绿色,反应③中有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则反应③的化学方程式是______________
(4)若A、B、D为有机物,B的相对分子质量比A大14,E、F为无机物单质,F是短周期中原子半径最大的元素。C为最常见的氧化物,通常状况下为液态,C能与乙烯在一定条件下发生加成反应生成A。则E的化学式为______________,D的结构简式为______________,反应①属于______________反应,反应③的化学方程式为______________
查看习题详情和答案>>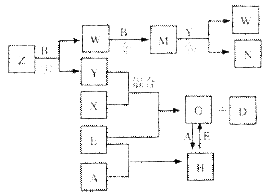 A、B、C、D、E是中学化学常见的五种单质,已知A、B、C、D在常温下均为气态,E为金属,其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
A、B、C、D、E是中学化学常见的五种单质,已知A、B、C、D在常温下均为气态,E为金属,其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
(1)化合物Z的空间构型为 ;构成A的元素的最高价氧化物水化物的化学式为 ;实验室贮存N的方法是 。
(2)写出反应②的化学反应方程式 ;G→H的离子方程式 。
(3)常温下,D与A反应生成1 mol X时放热92.3kJ,写出该反应的热化学方程式:
。
(4)将过量的E加入N的稀溶液中,若反应过程中转移电子的数目为3.01×1023,则参加反应的E的质量为 g。
查看习题详情和答案>>