摘要: 在20克稀硫酸里放一片锌.过一会儿.把锌片取出.称得液体的质量为23.15克.问实验过程中消耗锌的质量是多少?
网址:http://m.1010jiajiao.com/timu3_id_3991888[举报]
在实验室开放日,老师给某化学兴趣的同学一包氧化铜和铜的混合物样品.要求该兴趣小组的同学测定样品中氧化铜的质量分数.同学们称取5克样品放于烧杯中,再把20克稀硫酸平均分四次加入烧杯中并搅拌,上期充分反应.有关实验数据如下表:
计算:(1)样品中氧化铜的质量分数.
(2)所用稀硫酸中溶质的质量分数. 查看习题详情和答案>>
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 5 | 5 | 5 | 5 |
| 烧杯中剩余固体的质量/g | 4.2 | 3.4 | 3.0 | 3.0 |
(2)所用稀硫酸中溶质的质量分数. 查看习题详情和答案>>
在实验室开放日,老师给某化学兴趣的同学一包氧化铜和铜的混合物样品.要求该兴趣小组的同学测定样品中氧化铜的质量分数.同学们称取5克样品放于烧杯中,再把20克稀硫酸平均分四次加入烧杯中并搅拌,上期充分反应.有关实验数据如下表:
计算:(1)样品中氧化铜的质量分数.
(2)所用稀硫酸中溶质的质量分数.
查看习题详情和答案>>
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 5 | 5 | 5 | 5 |
| 烧杯中剩余固体的质量/g | 4.2 | 3.4 | 3.0 | 3.0 |
(2)所用稀硫酸中溶质的质量分数.
查看习题详情和答案>>
在实验室开放日,老师给某化学兴趣的同学一包氧化铜和铜的混合物样品。要求该兴趣小组的同学测定样品中氧化铜的质量分数。同学们称取5克样品放于烧杯中,再把20克稀硫酸平均分四次加入烧杯中并搅拌,上期充分反应。有关实验数据如下表:
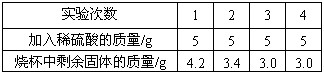
计算:
(1)样品中氧化铜的质量分数。
(2)所用稀硫酸中溶质的质量分数。
查看习题详情和答案>>
(1)样品中氧化铜的质量分数。
(2)所用稀硫酸中溶质的质量分数。
在实验室开放日,老师给某化学兴趣的同学一包氧化铜和铜的混合物样品.要求该兴趣小组的同学测定样品中氧化铜的质量分数.同学们称取5克样品放于烧杯中,再把20克稀硫酸平均分四次加入烧杯中并搅拌,上期充分反应.有关实验数据如下表:
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 5 | 5 | 5 | 5 |
| 烧杯中剩余固体的质量/g | 4.2 | 3.4 | 3.0 | 3.0 |
(2)所用稀硫酸中溶质的质量分数. 查看习题详情和答案>>
铜合金有很多种类.常见的有铜锌合金、铜铝合金、铜银合金、铜铁合金.现有一种铜合金.为确定其为四种合金中哪一种,作如下实验:将20克合金样品研成粉末,分成等质量的两份:其中一份加入到足量的20克稀硫酸中,合金部分溶解,有气泡产生.反应后过滤.得固体3.5克;另一份加入到49.9克硫酸铜溶液中,充分反应后过滤,得到无色滤液和固体9.9克.将固体放人到稀H2SO4中不溶解.
(1)该合金的成分为 ;
(2)加入到硫酸铜溶液中发生反应的化学方程式为 ;
(3)求与硫酸铜反应的金属质量(x)的比例式为 ;
(4)合金样品中铜的质量分数为 ;
(5)与硫酸铜溶液反应后所得无色溶液中溶质质量分数为 .
查看习题详情和答案>>
(1)该合金的成分为
(2)加入到硫酸铜溶液中发生反应的化学方程式为
(3)求与硫酸铜反应的金属质量(x)的比例式为
(4)合金样品中铜的质量分数为
(5)与硫酸铜溶液反应后所得无色溶液中溶质质量分数为