网址:http://m.1010jiajiao.com/timu3_id_399188[举报]
右图纵坐标为反应物的转化率,横坐标为温度(t℃),下列符合此图情况的反应是
 A.C(s)+CO2(g)
A.C(s)+CO2(g)![]() 2CO(g);△H>0
2CO(g);△H>0
B.H2(g)+Br2(g)![]() 2HBr(g);△H<0
2HBr(g);△H<0
C.N2(g)+3H2(g)![]() 2NH3(g);△H<0
2NH3(g);△H<0
D.2SO3(g)![]() 2SO2(g)+O2(g);△H>0
2SO2(g)+O2(g);△H>0
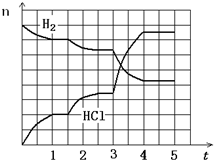 (2013?河东区一模)工业上高纯硅可以通过下列反应制取:
(2013?河东区一模)工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)
| 高温 |
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,H2的平均反应速率为
(2)该反应的平衡常数表达式K=
| c4(HCl) |
| c(SiCl4)?c2(H2) |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是
a.2v逆(SiCl4)=v正(H2) b.断开4mol Si-Cl键的同时,生成4mol H-Cl键
c.混合气体密度保持不变 d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如右图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是
甲醇是一种化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO .2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
②.变化的热量数值Q中, Q1与Q2的和是
③.画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,
要求画出压强不同的两条曲线(标出p1、p2,且p1<p2)。
④.在一定温度和压强下,CO和H2催化合成二甲醚反应为:
3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
查看习题详情和答案>>
CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
查看习题详情和答案>>
CO(g)+2H2(g)
 CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO .2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
②.变化的热量数值Q中, Q1与Q2的和是
③.画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,
要求画出压强不同的两条曲线(标出p1、p2,且p1<p2)。
④.在一定温度和压强下,CO和H2催化合成二甲醚反应为:
3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为 甲醇是一种化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g)![]() CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO .2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
①.容器内压强P:2P甲与2P乙与P丙关系是
②.变化的热量数值Q中, Q1 与Q2的和是
③.画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,
要求画出压强不同的两条曲线(标出p1、p2,且p1<p2)。
④.在一定温度和压强下,CO和H2催化合成二甲醚反应为:
3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为
CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为