网址:http://m.1010jiajiao.com/timu3_id_398890[举报]
DB3化合物,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、C、E三种元素的元素符号
A__________C__________E__________
(2)A、B形成的化合物与DB2反应生成一种强酸的化学方程式为____________________
(3)已知DB2在一定条件下可转化为DB3(g),1molDB2完全反应,放出98.3kJ的热量。该反应的热化学方程式是____________________,工业上进行这一反应的设备是__________,反应的适宜条件为
_________________。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为________________;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是____________________。 若改用铁棒做阳极材料,则阳极的电极反应式为____________________。阴极反应式为____________________。
(15分)现有A、B、C、D、E六种元素原子序数依次增大,只有E不是短周期元素;对其分别描述如下表:
元素编号 | 元素描述 |
A | 周期表中原子半径最小 |
B | 其氢化物可作致冷剂 |
C | 所处周期数、族序数都与电子层数相等 |
D | 最高化合价为+7 |
E | 用量最大,应用最广泛的金属 |
(1)元素D的最高价氧化物为无色液体,该物质与一定量水混合得到一种稀溶液。写出该反应的化学方程式_______________________ ;
(2)用一个化学方程式表示C与E的金属性强弱_______。
(3)A与B两种元素组成一种阳离子,检验某溶液中含有该离子的方法是:_________________。
(4)含C的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是_________________。(用离子方程式表示)
(5)E单质在海水中易被腐蚀,写出正极反应式:_________________
查看习题详情和答案>>
(Ⅰ)A、B、C、D、E五种元素在周期表里的位置如下表所示:
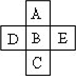
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素.D元素名称是________,在周期表第________周期,第________族,其原子结构示意图________.
(Ⅱ)A、B、C、D、E、F六种短周期元素的原子序数依次增大.已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个.试回答:
(1)写出下列元素的符号A________,D________,E________.
(2)A、C两种元素最高价氧化物的水化物之间反应的离子方程式________.
A、B、C、D、E六种短周期元素的原子序数依次增大.已知A、C、E三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多3个.
试回答:
①写出下列元素的符号A________,C________;
②用电子式表示B、E形成的化合物________;
③D的一种单质D4难溶于水,易溶于CS2,请解释原因________.
(1)写出下列元素的元素符号:C
(2)写出E元素原子的价电子轨道表示式


(3)B、C两元素原子的电负性大小:B
(4)A2C与A2D的熔沸点:A2C
(5)A、C两元素按原子个数比为1:1结合成的化合物化学式为
(6)BA3的中心原子杂化方式为