网址:http://m.1010jiajiao.com/timu3_id_398492[举报]
(13分)铁是生活中的常见金属,也是高中所学的过渡元素,由于其结构特点,在与其化物质反应时往往表现出不同的价态。某研究性学习小组对铁和硫反应产物中铁的化合价进行了探究,并设计了以下实验,其实验的步骤为:
步骤一:将铁粉和硫粉按一定质量比混合,如图所示在氮气环境中,加热后反立即可发生并持续进行,冷却后得到黑色固体。
步骤二:取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣。
在取得黑色滤渣后,同学们经过讨论分析,对其成分提出了各种猜想,其中代表性的为:
猜想一:由于硫和氧是同一主族元素,所以黑色固体的可能是Fe3S4
猜想二:硫和氧虽是同一主族元素,但硫的非金属性弱,则黑色固体为Fe
为了验证以上猜想又进行了以下操作:
步骤三:在滤渣中加入已煮沸的稀硫酸。
步骤四:取步骤三所得溶液少许,……。
请回答下列问题:
(1)查阅资料:实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应得氮气。请写出该反应的离子方程式: 。
(2)实验中通入氮气的作用 。
(3)若猜想一正确,则步骤三应该观察到试管内有 出现(填实验现象)。
(4)若猜想二正确,请完成步骤四的实验操作、现象和结论 。
(5)步骤一中铁粉和硫粉的混合粉末中硫要过量些,其原因是 。
(6)步骤二中加入浓NaOH溶液并稍稍加热的目的是 。
查看习题详情和答案>>
(13分)铁是生活中的常见金属,也是高中所学的过渡元素,由于其结构特点,在与其化物质反应时往往表现出不同的价态。某研究性学习小组对铁和硫反应产物中铁的化合价进行了探究,并设计了以下实验,其实验的步骤为:
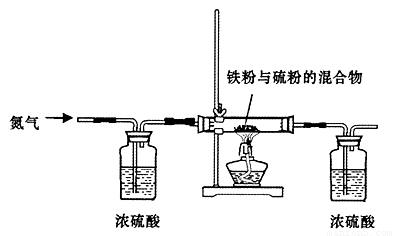
步骤一:将铁粉和硫粉按一定质量比混合,如图所示在氮气环境中,加热后反立即可发生并持续进行,冷却后得到黑色固体。
步骤二:取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣。
在取得黑色滤渣后,同学们经过讨论分析,对其成分提出了各种猜想,其中代表性的为:
猜想一:由于硫和氧是同一主族元素,所以黑色固体的可能是Fe3S4
猜想二:硫和氧虽是同一主族元素,但硫的非金属性弱,则黑色固体为Fe
为了验证以上猜想又进行了以下操作:
步骤三:在滤渣中加入已煮沸的稀硫酸。
步骤四:取步骤三所得溶液少许,……。
请回答下列问题:
(1)查阅资料:实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应得氮气。请写出该反应的离子方程式: 。
(2)实验中通入氮气的作用 。
(3)若猜想一正确,则步骤三应该观察到试管内有 出现(填实验现象)。
(4)若猜想二正确,请完成步骤四的实验操作、现象和结论 。
(5)步骤一中铁粉和硫粉的混合粉末中硫要过量些,其原因是 。
(6)步骤二中加入浓NaOH溶液并稍稍加热的目的是 。
查看习题详情和答案>>
(13分)铁是生活中的常见金属,也是高中所学的过渡元素,由于其结构特点,在与其化物质反应时往往表现出不同的价态。某研究性学习小组对铁和硫反应产物中铁的化合价进行了探究,并设计了以下实验,其实验的步骤为: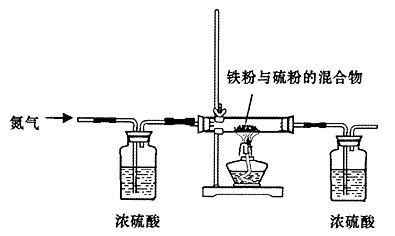
步骤一:将铁粉和硫粉按一定质量比混合,如图所示在氮气环境中,加热后反立即可发生并持续进行,冷却后得到黑色固体。
步骤二:取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣。
在取得黑色滤渣后,同学们经过讨论分析,对其成分提出了各种猜想,其中代表性的为:
猜想一:由于硫和氧是同一主族元素,所以黑色固体的可能是Fe3S4
猜想二:硫和氧虽是同一主族元素,但硫的非金属性弱,则黑色固体为FeS
为了验证以上猜想又进行了以下操作:
步骤三:在滤渣中加入已煮沸的稀硫酸。
步骤四:取步骤三所得溶液少许,……。
请回答下列问题:
(1)查阅资料:实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应得氮气。请写出该反应的离子方程式: 。
(2)实验中通入氮气的作用 。
(3)若猜想一正确,则步骤三应该观察到试管内有 出现(填实验现象)。
(4)若猜想二正确,请完成步骤四的实验操作、现象和结论 。
(5)步骤一中铁粉和硫粉的混合粉末中硫要过量些,其原因是 。
(6)步骤二中加入浓NaOH溶液并稍稍加热的目的是 。
铁是生活中的常见金属,也是高中所学的过渡元素,由于其结构特点,在与其化物质反应时往往表现出不同的价态.某研究性学习小组对铁和硫反应产物中铁的化合价进行了探究,并设计了以下实验,其实验的步骤为:

步骤一:将铁粉和硫粉按一定质量比混合,如图所示在氮气环境中,加热后反立即可发生并持续进行,冷却后得到黑色固体.
步骤二:取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣.
在取得黑色滤渣后,同学们经过讨论分析,对其成分提出了各种猜想,其中代表性的为:
猜想一:由于硫和氧是同一主族元素,所以黑色固体的可能是Fe3S4
猜想二:硫和氧虽是同一主族元素,但硫的非金属性弱,则黑色固体为Fe
为了验证以上猜想又进行了以下操作:
步骤三:在滤渣中加入已煮沸的稀硫酸.
步骤四:取步骤三所得溶液少许,…….
请回答下列问题:
(1)查阅资料:实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应得氮气.请写出该反应的离子方程式:________.
(2)实验中通入氮气的作用________.
(3)若猜想一正确,则步骤三应该观察到试管内有________出现(填实验现象).
(4)若猜想二正确,请完成步骤四的实验操作、现象和结论________.
(5)步骤一中铁粉和硫粉的混合粉末中硫要过量些,其原因是________.
(6)步骤二中加入浓NaOH溶液并稍稍加热的目的是________.