网址:http://m.1010jiajiao.com/timu3_id_39844[举报]
已知元素周期表中的各周期可排列元素数目如下:周期1234567元素数目28818183232人们预测元素周期表第8周期将来也会排满,那么该周期排满时会排________种元素.
- A.18
- B.32
- C.50
- D.无法知道
 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为
(3)与C同族且位于第四周期元素所形成气态氢化物的电子式为


(4)F的基态原子核外电子排布式是
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为
| 3 |
| ||
| 3 |
| ||
已知周期表中,元素Q、R、W、Y与元素X相邻。Y 的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧 化物的晶体类型是________;
(2)Q的具有相同化合价且可以相互转变的氧化物是__________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 __________________;
(4)这5种元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序 是(填化学式)________________________,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②电子总数相同的氢化物的化学式和立体结构分别是
________________________________________________________________________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加 热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和 该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 ________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看习题详情和答案>>(14分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)C形成的晶体中,其微粒堆积方式为 ;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为: ;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为 。
(4)E核外电子排布式是 ,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有
查看习题详情和答案>>
(14分)下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 一 | ① | | ||||||
| 二 | | | | ② | ③ | ④ | | |
| 三 | ⑤ | | ⑥ | ⑦ | | ⑧ | | |
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式: 、 。
(3)①、④、⑤三种元素形成的化合物中化学键的类型: 。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的化学方程式: 。
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应:
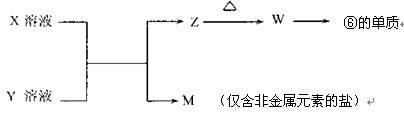
①X溶液与Y溶液反应的离子方程式为 ;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:
c( )>c( )>c( )>c( )(在括号内填离子符号)。 查看习题详情和答案>>