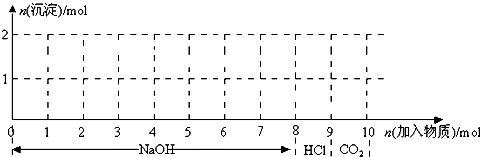
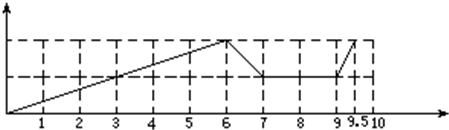
摘要:14.现有含21.2gNa2CO3的溶液和60g溶质质量分数为18.25%的盐酸.欲用这两种药品制取CO2.甲方案:向Na2CO3溶液中逐滴加入盐酸.乙方案:向盐酸中逐滴加入Na2CO3溶液.用两种方案制得的CO2可能是 ( ) A.2.2g B.4.4g C.6.6g D.8.8g
网址:http://m.1010jiajiao.com/timu3_id_398438[举报]
硝酸工业尾气中氮氧化物(NO 和NO2)是主要的大气污染物之一,可用氨氧混合气体进行选择性还原处理.其主要反应原理如下:
4NO+4NO3+O2
4N2+6H2O 6NO+8NH3
7N2+12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO、NO2的物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
(1)尾气中氮氧化物的平均相对原子量为 ;尾气中NO的含量为 mg/m3.
(2)要处理5m3的尾气,需要氨氧混合气的体积为 L.
(3)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积25% NaOH溶液(密度1.28g/cm3)完全吸收.
①NaOH溶液的物质的量浓度为 mol/L,体积为 mL.
②已知反应后溶液含有0.35mol NaNO2.若将尾气NO和NO2的平均组成用NOx表示,则x= .
查看习题详情和答案>>
4NO+4NO3+O2
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO、NO2的物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
(1)尾气中氮氧化物的平均相对原子量为
(2)要处理5m3的尾气,需要氨氧混合气的体积为
(3)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积25% NaOH溶液(密度1.28g/cm3)完全吸收.
①NaOH溶液的物质的量浓度为
②已知反应后溶液含有0.35mol NaNO2.若将尾气NO和NO2的平均组成用NOx表示,则x=
 [化学--物质结构与性质
[化学--物质结构与性质 Ⅰ.(1)原子数相同,价电子数也相同的微粒,称为等电子体.等电子体具有相似的化学键特征,性质相似.CO的结构式为
C≡O
C≡O
.Ⅱ.(2)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、航天航空材料,被誉为“未来世界的金属”. 钛的基态原子的电子排布式为
1s22s22p63s23p63d24s2
1s22s22p63s23p63d24s2
.(3)偏钛酸钡在小型变压器、话筒和扩音器中都有●Ti应用.偏钛酸钡为离子晶体,晶胞的结构如图 所示,它的化学式是
BaTiO3
BaTiO3
.(4)现有含Ti3+的配合物,化学式为TiCl3(H2O)6,将1mol该物质溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为l mol,已知该配合物的配位数为6,则该配合物的配位体是
Cl-、H2O
Cl-、H2O
.1mol该配合物外界所含 结晶水的物质的量为2
2
mol.现有含FeCl2杂质的氯化铜晶体(CuCl2?2H2O),为制取纯净的CuCl2?2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:

已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH如下表.
请回答下列问题:
(1)本实验最适合的氧化剂X是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加氧化剂的目的是
(3)物质Y是
(4)除去Fe3+的有关离子方程式是
(5)加入物质Y后得到的沉淀是
(6)最后能不能直接蒸发结晶得到CuCl2?2H2O晶体?
查看习题详情和答案>>

已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH如下表.
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时约pH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
(1)本实验最适合的氧化剂X是
C
C
(填序号).A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加氧化剂的目的是
将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离
将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离
.(3)物质Y是
CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3
CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3
(写化学式),加入Y的目的是调节溶液的pH至3.2~4.7
调节溶液的pH至3.2~4.7
.(4)除去Fe3+的有关离子方程式是
Fe3++3H2O?Fe(OH)3+3H+,CuO+2H+═Cu2++H2O
Fe3++3H2O?Fe(OH)3+3H+,CuO+2H+═Cu2++H2O
.(5)加入物质Y后得到的沉淀是
Fe(OH)3
Fe(OH)3
(写化学式).如何洗涤该沉淀沉淀?加蒸馏水至刚好淹没沉淀,过滤,重复几次
加蒸馏水至刚好淹没沉淀,过滤,重复几次
.(6)最后能不能直接蒸发结晶得到CuCl2?2H2O晶体?
不能
不能
,应如何操作?应在HCl的气流中加热蒸发
应在HCl的气流中加热蒸发
.(2013?闵行区二模)开展“三废”综合治理,是防治工业“三废”污染,搞好环境保护的重要途径之一.其中常用方法是将“三废”中有毒有害物转化为无害的物质或有用的产品.
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:
4NO+4NH3+O2
4N2+6H2O 6NO2+8NH3
7N2+12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
①氨氧混合气的平均相对分子质量为
②尾气中NO的含量为
③要处理5m3的尾气,需要氨氧混合气的体积为
(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收.
①NaOH溶液的物质的量浓度为
②已知反应后溶液中含有0.35mol NaNO2.若将尾气中NO与NO2的平均组成记为NOx,则x=
(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4?2H2O).已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗).
查看习题详情和答案>>
(1)硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:
4NO+4NH3+O2
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
①氨氧混合气的平均相对分子质量为
19.37
19.37
(精确到0.01).②尾气中NO的含量为
1800
1800
mg/m3.③要处理5m3的尾气,需要氨氧混合气的体积为
10.64
10.64
L.(2)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收.
①NaOH溶液的物质的量浓度为
8
8
mol/L,体积为62.5
62.5
mL.②已知反应后溶液中含有0.35mol NaNO2.若将尾气中NO与NO2的平均组成记为NOx,则x=
1.8
1.8
.(3)硫酸工业的废水中含质量分数4.9%的硫酸,加入质量分数22.2%的石灰乳,恰好使废水达到排放标准(pH=7),同时又得到副产品石膏(CaSO4?2H2O).已知按此法处理后每小时可排放达标废水276.5吨,求每小时生产石膏的质量(忽略其他反应且不计过程中损耗).