摘要:用实验证明锌和铜两种金属的活动性顺序可选用的试剂----------- A.稀硫酸 B.AgNO3溶液 C.Na2SO4溶液 D.ZnCl2溶液
网址:http://m.1010jiajiao.com/timu3_id_3984150[举报]
(2007?连云港)某研究性学习小组在综合实践活动中对某化工厂化验室排出的废水感兴趣,并对其进行了探究:
[调查获悉]废水中含有硝酸亚铁、硝酸银
[查阅资料]含硝酸亚铁的溶液呈浅绿色
[实验目的]探究用锌从废水中最大程度地回收金属银的方法;探究锌和废水中硝酸亚铁、硝酸银的反应顺序
[实验用品]废水、所需化学试剂及相关的仪器、用品
[设计方案]他们设计了如下方案:
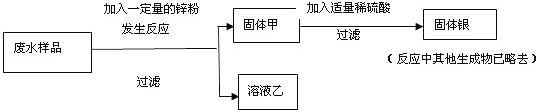
[发现问题]小组成员分别进行实验,在得到固体甲的同时发现:有些同学得到无色溶液乙,有些同学得到深浅不同的浅绿色溶液乙,小丹同学提出问题:哪种结果能最大程度地回收金属银呢?锌与废水中哪种物质先反应呢?
[讨论分析]小军同学认为:这个问题必须通过探究溶液乙或固体甲的组成才能回答,此观点得到了大家的赞同,经研究,他们决定探究溶液乙.于是他们分成两小组,第一组对无色溶液进行探究,第二组对浅绿色溶液进行探究:
(1)首先他们对溶液乙中的溶质作出了多种猜想:
第一组:①溶质为 Zn(NO3)2 ②溶质为 Zn(NO3)2、AgNO3
第二组:③溶质为 Fe(NO3)2和
(2)小悦同学思考后指出:“通过实验或推理,都能排除第一组同学提出的猜想②,从而确立猜想①是合理的”,请你叙述其推理过程
.
(3)第二组同学经过向不同的浅绿色溶液中加入一种试剂,观察实验现象后得出结论,使③④两种猜想都得以验证.请你参与到实验操作过程中并完成下表:
[交流后得出结论]
(4)当反应后溶液呈无色,溶质为
[探究后反思](5)老师评价:这种方法虽然方便、快捷,但也有不足,请你指出它的不足
查看习题详情和答案>>
[调查获悉]废水中含有硝酸亚铁、硝酸银
[查阅资料]含硝酸亚铁的溶液呈浅绿色
[实验目的]探究用锌从废水中最大程度地回收金属银的方法;探究锌和废水中硝酸亚铁、硝酸银的反应顺序
[实验用品]废水、所需化学试剂及相关的仪器、用品
[设计方案]他们设计了如下方案:

[发现问题]小组成员分别进行实验,在得到固体甲的同时发现:有些同学得到无色溶液乙,有些同学得到深浅不同的浅绿色溶液乙,小丹同学提出问题:哪种结果能最大程度地回收金属银呢?锌与废水中哪种物质先反应呢?
[讨论分析]小军同学认为:这个问题必须通过探究溶液乙或固体甲的组成才能回答,此观点得到了大家的赞同,经研究,他们决定探究溶液乙.于是他们分成两小组,第一组对无色溶液进行探究,第二组对浅绿色溶液进行探究:
(1)首先他们对溶液乙中的溶质作出了多种猜想:
第一组:①溶质为 Zn(NO3)2 ②溶质为 Zn(NO3)2、AgNO3
第二组:③溶质为 Fe(NO3)2和
Zn(NO3)
Zn(NO3)
④溶质为 Fe(NO3)2、Zn(NO3)2
Zn(NO3)2
和AgNO3
AgNO3
(2)小悦同学思考后指出:“通过实验或推理,都能排除第一组同学提出的猜想②,从而确立猜想①是合理的”,请你叙述其推理过程
若猜想②成立,说明Fe(NO3)2与Zn反应生成Fe,而Fe会与过滤前的溶液中AgNO3反应,即铁和AgNO3不可能都有,从而排除猜想②
若猜想②成立,说明Fe(NO3)2与Zn反应生成Fe,而Fe会与过滤前的溶液中AgNO3反应,即铁和AgNO3不可能都有,从而排除猜想②
.
(3)第二组同学经过向不同的浅绿色溶液中加入一种试剂,观察实验现象后得出结论,使③④两种猜想都得以验证.请你参与到实验操作过程中并完成下表:
| 实验操作 | 实验现象和结论 |
| 取少量乙溶液于试管中, 在溶液中插入一根铜丝 在溶液中插入一根铜丝 ,观察.或者(取少量乙溶液于试管中, 滴加几滴稀盐酸(或其他氯化物溶液) 滴加几滴稀盐酸(或其他氯化物溶液) ) | 若 铜丝表面无变化 铜丝表面无变化 ,则是Zn(NO3)2、Fe(NO3)2 Zn(NO3)2、Fe(NO3)2 ,若铜丝表面有银白色固体析出 铜丝表面有银白色固体析出 则是Zn(NO3)2、Fe(NO3)2、AgNO3 Zn(NO3)2、Fe(NO3)2、AgNO3 .或者(若 溶液无明显变化 溶液无明显变化 ,则溶质是Zn(NO3)2、Fe(NO3)2 Zn(NO3)2、Fe(NO3)2 ,若溶液中有沉淀生成 溶液中有沉淀生成 ,则溶质是Zn(NO3)2、Fe(NO3)2、AgNO3 Zn(NO3)2、Fe(NO3)2、AgNO3 .) |
(4)当反应后溶液呈无色,溶质为
Zn(NO3)2
Zn(NO3)2
或当反应后溶液呈浅绿色,溶质为Zn(NO3)2
Zn(NO3)2
和Fe(NO3)2
Fe(NO3)2
时,能最大程度地回收金属银.通过探究,同学们认为:“使用过量的锌,过滤后得无色溶液”是方便、快捷并确保最大程度地回收金属银的一种方法.经过观察和思考,同学们还得出了 Zn先和废水中AgNO3
AgNO3
反应,再和Fe(NO3)2
Fe(NO3)2
反应的结论.[探究后反思](5)老师评价:这种方法虽然方便、快捷,但也有不足,请你指出它的不足
浪费一些锌和稀硫酸,最好能对亚铁盐和锌盐进行回收利用,又能减少污染(或其他合理答案)
浪费一些锌和稀硫酸,最好能对亚铁盐和锌盐进行回收利用,又能减少污染(或其他合理答案)
.氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂.
【资料在线】
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝.
探究一:定性分析
(1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气你支持
(2)CaH2中氢元素的化合价是
(3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是
(4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.
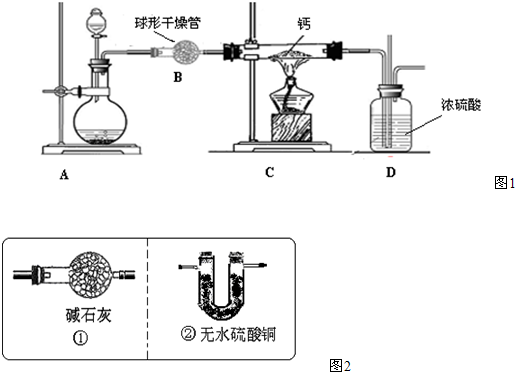
装置A 中装有锌粒和稀硫酸,请写出其反应的化学方程式
(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确
探究二:产物定量测定
测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法.
(1)取氢化钙样品与水反应,利用图1装置测定生成的气体体积时,在
A.气泡连续均匀时
B.刚开始有气泡时
(2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用图2装置测定气体体积.该装置的优点是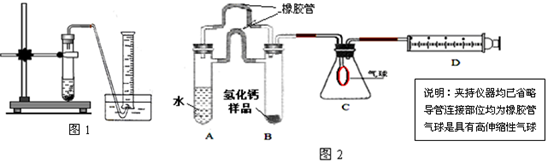
(3)称取46mg 所制得的氢化钙样品,注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是
反思提高:
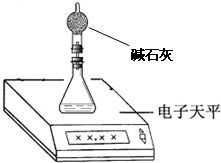
(1)上述实验在学校的实验室内,通过托盘天平等称量工具
(2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏
查看习题详情和答案>>
【资料在线】
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝.
探究一:定性分析
(1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气你支持
乙
乙
(填“甲”、“乙”)观点,理由是钙与水反应若生成氧气,反应前后氢氧原子个数比不守恒(反应前氢氧原子个数比为2/1,反应后会大于2/1)
钙与水反应若生成氧气,反应前后氢氧原子个数比不守恒(反应前氢氧原子个数比为2/1,反应后会大于2/1)
.(2)CaH2中氢元素的化合价是
-1
-1
,写出CaH2与水反应的化学方程式CaH2+2H2O═Ca(OH)2+2H2↑
CaH2+2H2O═Ca(OH)2+2H2↑
;(3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是
固体燃料携带方便,且水是登山运动员必须携带物质,有水就能提供出高能量的氢能
固体燃料携带方便,且水是登山运动员必须携带物质,有水就能提供出高能量的氢能
;(4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.

装置A 中装有锌粒和稀硫酸,请写出其反应的化学方程式
Zn+H2SO4═ZnSO4+H2↑;
Zn+H2SO4═ZnSO4+H2↑;
,装置B 中装有无水氯化钙,其作用是除去氢气中混有的水蒸气
除去氢气中混有的水蒸气
,若要证明进入C 装置中的氢气已经干燥,在B、C之间应连接下图中的哪个装置:②
②
(填①或②),现象是无水硫酸铜不变色
无水硫酸铜不变色
.(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确
否
否
(填“是”或“否”);原因是因为Ca+2H2O═Ca(OH)2+H2↑也能呈现相同的现象
因为Ca+2H2O═Ca(OH)2+H2↑也能呈现相同的现象
.探究二:产物定量测定
测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法.
(1)取氢化钙样品与水反应,利用图1装置测定生成的气体体积时,在
B
B
即进行收集(填字母).A.气泡连续均匀时
B.刚开始有气泡时
(2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用图2装置测定气体体积.该装置的优点是
①排除了“因液体加入引起气体排出导致的气体体积测定误差”的可能;②避免了实验操作时,无论塞紧橡皮塞的动作多快,都会有气体逸散的可能;③胶皮管能使两支管内中气体压强保持平衡,便于管A中液体顺利流入管B;④评价气球:气球膨胀过程还可以在一定程度上缓冲一下压强,以防氢气直接快速进入注射器,造成活塞脱落,导致实验失败
①排除了“因液体加入引起气体排出导致的气体体积测定误差”的可能;②避免了实验操作时,无论塞紧橡皮塞的动作多快,都会有气体逸散的可能;③胶皮管能使两支管内中气体压强保持平衡,便于管A中液体顺利流入管B;④评价气球:气球膨胀过程还可以在一定程度上缓冲一下压强,以防氢气直接快速进入注射器,造成活塞脱落,导致实验失败
,如何实现A中的水与B中样品接触而发生反应因为AB管连接处均有胶皮管连接,所以慢慢倾斜A管,直至液体流入B
因为AB管连接处均有胶皮管连接,所以慢慢倾斜A管,直至液体流入B
.
(3)称取46mg 所制得的氢化钙样品,注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是
91.30%
91.30%
.(设该条件下每11.2mL氢气的质量为1mg)反思提高:
(1)上述实验在学校的实验室内,通过托盘天平等称量工具
不能
不能
(填“能”、“不能”)完成.(2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏
偏低
偏低
.
 铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.
铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.问题一:硫酸铜溶液的配制
小明同学在实验室配制硫酸铜溶液时意外地发现有时会出现少量白色浑浊,对此,他和化学兴趣小组同学作出如下探究.
| 配置用水 | 有浑浊 | 有浑浊 |
| 自来水 | 无浑浊 | 有浑浊 |
| 市售纯净水 | 无浑浊 | 有浑浊 |
| 医用纯净水 | 无浑浊 | 无浑浊 |
| 试验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 饱和溶液 | 2 | 4 | 6 | 8 | 16 | 32 | 128 |
| 现 象 | 白色浑浊→澄清 | ||||||
(1)形成浑浊条件分析:小明分别作出如图1配制方式,并记录现象如下:
另外,他将配好的饱和且澄清的硫酸铜溶液滴入纯净水中有如上现象,在配制过程中形成白色浑浊的因素可能有
(2)白色浑浊成分分析.
[查阅资料]同学们上网查阅资料获知:此白色沉淀是一种名为碱式硫酸铜的物质,它可溶于酸,其有多种可能的组成,如Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4等.为确定此次得到的白色沉淀究竟是哪种组成,小明设计实验如下:
[设计实验]称取5.16g白色沉淀,分成两等份:一份溶于足量的 中,向溶液中滴加足量的氯化钡溶液,过滤、洗涤、干燥,得2.33g白色固体;将另一份固体在空气中充分灼烧得到黑色固体1.60g.
[得出结论]通过计算确定该白色沉淀中Cu2+、OH-、SO42-的质量比为
问题二:氢氧化铜与葡萄糖反应产物的分析
利用新制氢氧化铜可以验证葡萄糖的存在.下面是三个研究性学习小组分别从不同层面对此实验开展的研究性学习活动:
Ⅰ.研究性学习小组甲对教材实验结论葡萄糖与新制氢氧化铜反应生成的红色沉淀是Cu2O,提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是
查阅资料:①氧化亚铜能与酸反应,得到+2价的铜离子和单质铜;②在空气中灼烧氧化亚铜生成氧化铜;③铜能与稀硝酸反应生成硝酸铜、水和一氧化氮.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b关系;
你认为合理的方案是
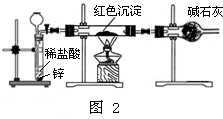
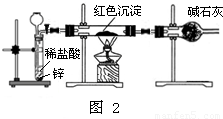
Ⅱ.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图2所示.
①通入氢气体积 ②反应前,红色沉淀+硬质玻璃管的总质量
③完全反应后,红色固体+硬质玻璃管的总质量 ④实验前,干燥管(含其中固体)质量
⑤硬质玻璃管质量 ⑥锌粒质量 ⑦稀硫酸中含溶质的量 ⑧实验后,干燥管(含其中固体)质量 (已知氢气在加热条件下能与金属氧化物发生置换反应,且假设反应能完全进行)
A.②④⑤⑧B.②③⑤C.①⑥⑦D.①②⑤
你认为需要测定上述
Ⅲ.研究性学习小组丙上网查阅得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂--胆矾(CuSO4?5H2O).他们设计了一个简单且符合绿色化学要求的实验方案:将红色固体反复灼烧后,用足量稀硫酸溶解,再将所得溶液蒸发结晶,减压过滤,用少量95%的酒精淋洗晶体,晾干或用滤纸吸干.晶体用酒精淋洗而不用水洗的好处是:
 铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.
铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.
问题一:硫酸铜溶液的配制
小明同学在实验室配制硫酸铜溶液时意外地发现有时会出现少量白色浑浊,对此,他和化学兴趣小组同学作出如下探究.
| 配置用水 | 有浑浊 | 有浑浊 |
| 自来水 | 无浑浊 | 有浑浊 |
| 市售纯净水 | 无浑浊 | 有浑浊 |
| 医用纯净水 | 无浑浊 | 无浑浊 |
| 试验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 饱和溶液 | 2 | 4 | 6 | 8 | 16 | 32 | 128 |
| 现 象 | 白色浑浊→澄清 | ||||||
(1)形成浑浊条件分析:小明分别作出如图1配制方式,并记录现象如下:
另外,他将配好的饱和且澄清的硫酸铜溶液滴入纯净水中有如上现象,在配制过程中形成白色浑浊的因素可能有________、________、________等,因此,在实验室配制硫酸铜溶液时要用的配制用水是________ (选填“自来水、市售纯净水、医用蒸馏水”)、在________(选填“较低温度、较高温度”)下配制稍浓些的硫酸铜溶液.
(2)白色浑浊成分分析.
[查阅资料]同学们上网查阅资料获知:此白色沉淀是一种名为碱式硫酸铜的物质,它可溶于酸,其有多种可能的组成,如Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4等.为确定此次得到的白色沉淀究竟是哪种组成,小明设计实验如下:
[设计实验]称取5.16g白色沉淀,分成两等份:一份溶于足量的 中,向溶液中滴加足量的氯化钡溶液,过滤、洗涤、干燥,得2.33g白色固体;将另一份固体在空气中充分灼烧得到黑色固体1.60g.
[得出结论]通过计算确定该白色沉淀中Cu2+、OH-、SO42-的质量比为________,其化学式为________. (写出计算过程,共4分)
问题二:氢氧化铜与葡萄糖反应产物的分析
利用新制氢氧化铜可以验证葡萄糖的存在.下面是三个研究性学习小组分别从不同层面对此实验开展的研究性学习活动:
Ⅰ.研究性学习小组甲对教材实验结论葡萄糖与新制氢氧化铜反应生成的红色沉淀是Cu2O,提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是________、________或二者混合物.
查阅资料:①氧化亚铜能与酸反应,得到+2价的铜离子和单质铜;②在空气中灼烧氧化亚铜生成氧化铜;③铜能与稀硝酸反应生成硝酸铜、水和一氧化氮.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b关系;
你认为合理的方案是________.
Ⅱ.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图2所示.
①通入氢气体积 ②反应前,红色沉淀+硬质玻璃管的总质量
③完全反应后,红色固体+硬质玻璃管的总质量 ④实验前,干燥管(含其中固体)质量
⑤硬质玻璃管质量 ⑥锌粒质量 ⑦稀硫酸中含溶质的量 ⑧实验后,干燥管(含其中固体)质量 (已知氢气在加热条件下能与金属氧化物发生置换反应,且假设反应能完全进行)
A.②④⑤⑧B.②③⑤C.①⑥⑦D.①②⑤
你认为需要测定上述________ (选择正确的字母填空)即可确定上述红色沉淀成分.
Ⅲ.研究性学习小组丙上网查阅得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂--胆矾(CuSO4?5H2O).他们设计了一个简单且符合绿色化学要求的实验方案:将红色固体反复灼烧后,用足量稀硫酸溶解,再将所得溶液蒸发结晶,减压过滤,用少量95%的酒精淋洗晶体,晾干或用滤纸吸干.晶体用酒精淋洗而不用水洗的好处是:________. 查看习题详情和答案>>
铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.
问题一:硫酸铜溶液的配制
小明同学在实验室配制硫酸铜溶液时意外地发现有时会出现少量白色浑浊,对此,他和化学兴趣小组同学作出如下探究.
图 1
(1)形成浑浊条件分析:小明分别作出如图1配制方式,并记录现象如下:
另外,他将配好的饱和且澄清的硫酸铜溶液滴入纯净水中有如上现象,在配制过程中形成白色浑浊的因素可能有______、______、______等,因此,在实验室配制硫酸铜溶液时要用的配制用水是______ (选填“自来水、市售纯净水、医用蒸馏水”)、在______(选填“较低温度、较高温度”)下配制稍浓些的硫酸铜溶液.
(2)白色浑浊成分分析.
[查阅资料]同学们上网查阅资料获知:此白色沉淀是一种名为碱式硫酸铜的物质,它可溶于酸,其有多种可能的组成,如Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4等.为确定此次得到的白色沉淀究竟是哪种组成,小明设计实验如下:
[设计实验]称取5.16g白色沉淀,分成两等份:一份溶于足量的 中,向溶液中滴加足量的氯化钡溶液,过滤、洗涤、干燥,得2.33g白色固体;将另一份固体在空气中充分灼烧得到黑色固体1.60g.
[得出结论]通过计算确定该白色沉淀中Cu2+、OH-、SO42-的质量比为______,其化学式为______. (写出计算过程,共4分)
问题二:氢氧化铜与葡萄糖反应产物的分析
利用新制氢氧化铜可以验证葡萄糖的存在.下面是三个研究性学习小组分别从不同层面对此实验开展的研究性学习活动:
Ⅰ.研究性学习小组甲对教材实验结论葡萄糖与新制氢氧化铜反应生成的红色沉淀是Cu2O,提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是______、______或二者混合物.
查阅资料:①氧化亚铜能与酸反应,得到+2价的铜离子和单质铜;②在空气中灼烧氧化亚铜生成氧化铜;③铜能与稀硝酸反应生成硝酸铜、水和一氧化氮.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b关系;
你认为合理的方案是______.
Ⅱ.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图2所示.
①通入氢气体积 ②反应前,红色沉淀+硬质玻璃管的总质量
③完全反应后,红色固体+硬质玻璃管的总质量 ④实验前,干燥管(含其中固体)质量
⑤硬质玻璃管质量 ⑥锌粒质量 ⑦稀硫酸中含溶质的量 ⑧实验后,干燥管(含其中固体)质量 (已知氢气在加热条件下能与金属氧化物发生置换反应,且假设反应能完全进行)
A.②④⑤⑧B.②③⑤C.①⑥⑦D.①②⑤
你认为需要测定上述______ (选择正确的字母填空)即可确定上述红色沉淀成分.
Ⅲ.研究性学习小组丙上网查阅得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂--胆矾.他们设计了一个简单且符合绿色化学要求的实验方案:将红色固体反复灼烧后,用足量稀硫酸溶解,再将所得溶液蒸发结晶,减压过滤,用少量95%的酒精淋洗晶体,晾干或用滤纸吸干.晶体用酒精淋洗而不用水洗的好处是:______.
 查看习题详情和答案>>
查看习题详情和答案>>
问题一:硫酸铜溶液的配制
小明同学在实验室配制硫酸铜溶液时意外地发现有时会出现少量白色浑浊,对此,他和化学兴趣小组同学作出如下探究.
| 配置用水 | 有浑浊 | 有浑浊 |
| 自来水 | 无浑浊 | 有浑浊 |
| 市售纯净水 | 无浑浊 | 有浑浊 |
| 医用纯净水 | 无浑浊 | 无浑浊 |
| 试验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 饱和溶液 | 2 | 4 | 6 | 8 | 16 | 32 | 128 |
| 现 象 | 白色浑浊→澄清 | ||||||
(1)形成浑浊条件分析:小明分别作出如图1配制方式,并记录现象如下:
另外,他将配好的饱和且澄清的硫酸铜溶液滴入纯净水中有如上现象,在配制过程中形成白色浑浊的因素可能有______、______、______等,因此,在实验室配制硫酸铜溶液时要用的配制用水是______ (选填“自来水、市售纯净水、医用蒸馏水”)、在______(选填“较低温度、较高温度”)下配制稍浓些的硫酸铜溶液.
(2)白色浑浊成分分析.
[查阅资料]同学们上网查阅资料获知:此白色沉淀是一种名为碱式硫酸铜的物质,它可溶于酸,其有多种可能的组成,如Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4等.为确定此次得到的白色沉淀究竟是哪种组成,小明设计实验如下:
[设计实验]称取5.16g白色沉淀,分成两等份:一份溶于足量的 中,向溶液中滴加足量的氯化钡溶液,过滤、洗涤、干燥,得2.33g白色固体;将另一份固体在空气中充分灼烧得到黑色固体1.60g.
[得出结论]通过计算确定该白色沉淀中Cu2+、OH-、SO42-的质量比为______,其化学式为______. (写出计算过程,共4分)
问题二:氢氧化铜与葡萄糖反应产物的分析
利用新制氢氧化铜可以验证葡萄糖的存在.下面是三个研究性学习小组分别从不同层面对此实验开展的研究性学习活动:
Ⅰ.研究性学习小组甲对教材实验结论葡萄糖与新制氢氧化铜反应生成的红色沉淀是Cu2O,提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是______、______或二者混合物.
查阅资料:①氧化亚铜能与酸反应,得到+2价的铜离子和单质铜;②在空气中灼烧氧化亚铜生成氧化铜;③铜能与稀硝酸反应生成硝酸铜、水和一氧化氮.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化;
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a、b关系;
你认为合理的方案是______.
Ⅱ.研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图2所示.
①通入氢气体积 ②反应前,红色沉淀+硬质玻璃管的总质量
③完全反应后,红色固体+硬质玻璃管的总质量 ④实验前,干燥管(含其中固体)质量
⑤硬质玻璃管质量 ⑥锌粒质量 ⑦稀硫酸中含溶质的量 ⑧实验后,干燥管(含其中固体)质量 (已知氢气在加热条件下能与金属氧化物发生置换反应,且假设反应能完全进行)
A.②④⑤⑧B.②③⑤C.①⑥⑦D.①②⑤
你认为需要测定上述______ (选择正确的字母填空)即可确定上述红色沉淀成分.
Ⅲ.研究性学习小组丙上网查阅得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂--胆矾.他们设计了一个简单且符合绿色化学要求的实验方案:将红色固体反复灼烧后,用足量稀硫酸溶解,再将所得溶液蒸发结晶,减压过滤,用少量95%的酒精淋洗晶体,晾干或用滤纸吸干.晶体用酒精淋洗而不用水洗的好处是:______.
 查看习题详情和答案>>
查看习题详情和答案>>