摘要:20.800℃时.在2L密闭容器内充入0.50molNO和0.25molO2 .发生如下反应: 2NO(g)+O2(g) 2NO2(g) △H<0.体系中.n(NO)随时间的变化如表: t(s) 0 1 2 3 4 5 n 0.50 0.35 0.28 0.25 0.25 0.25 (1)能说明该反应已达到平衡状态的是 . A.v(NO2)正=v(O2)逆 B.容器内压强保持不变 C.v(NO)逆=2v(O2)正 D.容器内气体颜色不变 (2)能使该反应的反应速率增大.且平衡向正反应方向移动的措施是 . A.适当升高温度 B.缩小反应容器的体积 C.增大O2的浓度 D.选择高效催化剂 (3)计算800℃时该反应的平衡常数K. (4)将上述反应进行到4s时的混合气体用足量的水吸收.为保证混合气体中NO.NO2全部转化为HNO3.计算还需通入的O2的体积.
网址:http://m.1010jiajiao.com/timu3_id_398321[举报]
800℃时,在2L密闭容器内充入0.50molNO和0.25molO2,发生如下反应:
2NO(g)+O2(g)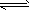 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表
2NO2(g) △H<0。体系中,n(NO)随时间的变化如表
2NO(g)+O2(g)
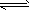 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表
2NO2(g) △H<0。体系中,n(NO)随时间的变化如表
(1)能说明该反应已达到平衡状态的是_______________。
A、v(NO2)正=v(O2)逆
B、容器内压强保持不变
C、v(NO)逆=2v(O2)正
D、容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是_________________。
A、适当升高温度
B、缩小反应容器的体积
C、增大O2的浓度
D、选择高效催化剂
(3)计算800℃时该反应的平衡常数K=____________。
查看习题详情和答案>>
A、v(NO2)正=v(O2)逆
B、容器内压强保持不变
C、v(NO)逆=2v(O2)正
D、容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是_________________。
A、适当升高温度
B、缩小反应容器的体积
C、增大O2的浓度
D、选择高效催化剂
(3)计算800℃时该反应的平衡常数K=____________。