摘要:(二)滤液含量的测定: 以下是该小组探究滤液的一个实验流程: 则100mL滤液中:①Cu2+ 的浓度为 mol·L-1 ,②Fe2+的浓度为 mol·L-1. 24.在一定量的石灰乳中通入一定量 的氯气.二者恰好完全反应(发生的反应 均为放热反应).生成物中含有Cl-.C1O-. C1O3-三种含氯元素的离子.其中C1O-. C1O3-两种离子的物质的量(n)与反应时 间(t)的曲线如右图所示. (1)t2时.Ca(OH)2与Cl2发生反应的总的化 学方程式为: . (2)该石灰乳中含有Ca(OH)2的物质的量是 mol. (3)据分析.生成Ca(C1O3)2的反应是由温度升高引起的.通入Cl2的速度不同.C1O-和C1O3-的比例也不同.在原石灰乳中: Ⅰ 若通入氯气的速度加快.则反应后 2(填“> .“< 或“= ), Ⅱ 若.则n(C1-)= mol(用含a的代数式来表示). 锦州市2009届普通高中高三上学期期末考试
网址:http://m.1010jiajiao.com/timu3_id_398301[举报]
为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4?7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式
(2)下列滴定方式中,最合理的是

(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应式
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

(3)步骤②中除用H2O2外还可以使用的物质是
(5)步骤②是否可以省略
(6)步骤④中一系列操作依次是:过滤、洗涤、
(7)假设实验无损耗,则每片补血剂含铁元素的质量
查看习题详情和答案>>
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
.(2)下列滴定方式中,最合理的是
B
B
(夹持部分略去)(填字母序号).
(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
250mL容量瓶
250mL容量瓶
(填仪器名称).(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应式
Fe2+-e-═Fe3+
Fe2+-e-═Fe3+
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

(3)步骤②中除用H2O2外还可以使用的物质是
氯水
氯水
.(5)步骤②是否可以省略
不能
不能
,理由是Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量
Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量
.(6)步骤④中一系列操作依次是:过滤、洗涤、
灼烧
灼烧
、冷却、称量.(7)假设实验无损耗,则每片补血剂含铁元素的质量
0.07a
0.07a
g(用含a的代数式表示).为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4?7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式______.
(2)下列滴定方式中,最合理的是______(夹持部分略去)(填字母序号).

(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______(填仪器名称).
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应式______
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
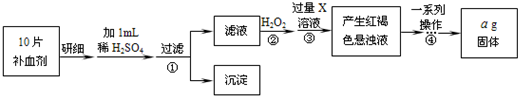
(3)步骤②中除用H2O2外还可以使用的物质是______.
(5)步骤②是否可以省略______,理由是______.
(6)步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示).
查看习题详情和答案>>
为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4?7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式______.
(2)下列滴定方式中,最合理的是______(夹持部分略去)(填字母序号).
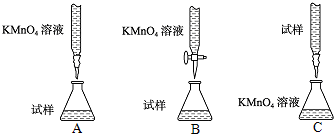
(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______(填仪器名称).
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应式______
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

(3)步骤②中除用H2O2外还可以使用的物质是______.
(5)步骤②是否可以省略______,理由是______.
(6)步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示).
查看习题详情和答案>>
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式______.
(2)下列滴定方式中,最合理的是______(夹持部分略去)(填字母序号).

(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______(填仪器名称).
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应式______
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

(3)步骤②中除用H2O2外还可以使用的物质是______.
(5)步骤②是否可以省略______,理由是______.
(6)步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示).
为测定该补血剂样品[主要成分是硫酸亚铁晶体]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式 .
(2)下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号).

(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称).
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应式
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
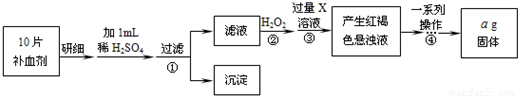
(3)步骤②中除用H2O2外还可以使用的物质是 .
(5)步骤②是否可以省略 ,理由是 .
(6)步骤④中一系列操作依次是:过滤、洗涤、 、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示). 查看习题详情和答案>>
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式 .
(2)下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号).

(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称).
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应式
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

(3)步骤②中除用H2O2外还可以使用的物质是 .
(5)步骤②是否可以省略 ,理由是 .
(6)步骤④中一系列操作依次是:过滤、洗涤、 、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示). 查看习题详情和答案>>
化学学习小组为测定某补血剂中硫酸亚铁的含量进行了以下探究:
【查阅资料】本品为糖衣片,除去糖衣后显淡蓝绿色,主要成分硫酸亚铁(FeSO4?7H2O).
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
【实验步骤】取本品10片,在适当的条件下配成100mL溶液,分别准确量取20mL溶液,用下列两种方法进行实验:
方法一:用一定物质的量浓度的酸性高锰酸钾溶液滴定.
方法二:加过量H2O2溶液,然后再加入过量NaOH溶液,得红褐色沉淀,将沉淀过滤并充分加热得红棕色固体,称量该固体的质量.
请回答下列问题:
(1)方法一中,配制一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有
(2)方法二中,加过量H2O2溶液的目的是
(3)在方法一中,若每消耗1mL酸性高锰酸钾溶液相当于0.152g FeSO4,则该溶液中高锰酸钾的物质的量浓度是
在方法二中,若称得红棕色固体的质量为a g,则每片补血剂含FeSO4
查看习题详情和答案>>
【查阅资料】本品为糖衣片,除去糖衣后显淡蓝绿色,主要成分硫酸亚铁(FeSO4?7H2O).
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
【实验步骤】取本品10片,在适当的条件下配成100mL溶液,分别准确量取20mL溶液,用下列两种方法进行实验:
方法一:用一定物质的量浓度的酸性高锰酸钾溶液滴定.
方法二:加过量H2O2溶液,然后再加入过量NaOH溶液,得红褐色沉淀,将沉淀过滤并充分加热得红棕色固体,称量该固体的质量.
请回答下列问题:
(1)方法一中,配制一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有
容量瓶
容量瓶
.(2)方法二中,加过量H2O2溶液的目的是
使Fe2+完全氧化成Fe3+
使Fe2+完全氧化成Fe3+
.有的同学认为使用新制氯水也能达到此目的,写出反应的离子方程式2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
,和使用新制氯水相比,用H2O2溶液的好处是无污染
无污染
.(3)在方法一中,若每消耗1mL酸性高锰酸钾溶液相当于0.152g FeSO4,则该溶液中高锰酸钾的物质的量浓度是
0.2mol?L-1
0.2mol?L-1
.在方法二中,若称得红棕色固体的质量为a g,则每片补血剂含FeSO4
0.95a
0.95a
g.