网址:http://m.1010jiajiao.com/timu3_id_398218[举报]
(共17分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的现象描述为 ________________
(17分)
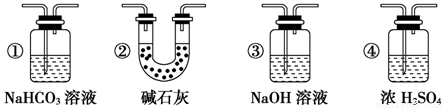
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。

(1)写出装置A中发生反应的离子方程式:
_____________________________________________________。
(2)装置D中黑色固体为 (填名称),反应的化学方程式为:
。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:__________________________________________________________。
(4)按照如图装置进行实验时,首先进行的操作名称是 。
(5)根据实验中的 现象,可证明CO具有还原性,有关反应的化学方程式是 。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置
与 之间连接下图中的 装置(填序号)。
查看习题详情和答案>>
(共17分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的现象描述为 ________________
查看习题详情和答案>>
(17分)
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
(1)写出装置A中发生反应的离子方程式:
_____________________________________________________。
(2)装置D中黑色固体为 (填名称),反应的化学方程式为:
。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:__________________________________________________________。
(4)按照如图装置进行实验时,首先进行的操作名称是 。
(5)根据实验中的 现象,可证明CO具有还原性,有关反应的化学方程式是 。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置
与 之间连接下图中的 装置(填序号)。
查看习题详情和答案>>
现有一瓶由两种液态有机物乙二醇和丙三醇(甘油)组成的混和液,根据下表性质判定,要将乙二醇和丙三醇相互分离的最佳方法是( )
|