网址:http://m.1010jiajiao.com/timu3_id_3981416[举报]
请回答下列问题:
(1)元素X位于周期表中第
(2)F的电子式
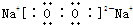
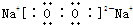
(3)Z与Y水溶液反应的离子方程式为
(4)D与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.该反应的氧化产物为
(5)F的溶液与稀硫酸反应产生的现象为
(12分)
某炼铁废渣中含有大量CuS及少量铁的化合物(铁元素的化合价为+2和+3价),工业上以该废渣为原料生产CuCl2的工艺流程如下:
焙烧过程中发生的主要反应为:CuS+2NaCl+2O2高温CuCl2+Na2SO4。
回答下列问题:
(1)焙烧前先进行粉碎的理由是_____________________________________________。
(2)试剂A应选用 (填编号)①NaClO、②Cl2、③H2O2溶液、④浓硫酸
加入试剂A的目的是____________________________________________________________。
(3)上述过滤操作中需要用到的玻璃仪器有_____________________________________________。
(4)从CuCl2溶液得到CuCl2晶体的操作是 (写出操作名称),该操作必需在HCl气流中进行,原因是_____________________________________________(用离子方程式表示)。
(5)如何检验滤液B中是否还有未沉淀的Fe3+______________________________,
加试剂A调节溶液pH=4时,c(Fe3+)为_______________。(已知Ksp[Fe(OH)3]=2.6×10-39)
(12分)
某炼铁废渣中含有大量CuS及少量铁的化合物(铁元素的化合价为+2和+3价),工业上以该废渣为原料生产CuCl2的工艺流程如下:

焙烧过程中发生的主要反应为:CuS+2NaCl+2O2高温CuCl2+Na2SO4。
回答下列问题:
(1)焙烧前先进行粉碎的理由是_____________________________________________。
(2)试剂A应选用 (填编号)①NaClO、②Cl2、③H2O2溶液、④浓硫酸
加入试剂A的目的是____________________________________________________________。
(3)上述过滤操作中需要用到的玻璃仪器有_____________________________________________。
(4)从CuCl2溶液得到CuCl2晶体的操作是 (写出操作名称),该操作必需在HCl气流中进行,原因是_____________________________________________(用离子方程式表示)。
(5)如何检验滤液B中是否还有未沉淀的Fe3+______________________________,
加试剂A调节溶液pH=4时,c(Fe3+)为_______________。(已知Ksp[Fe(OH)3]=2.6×10-39)
查看习题详情和答案>>
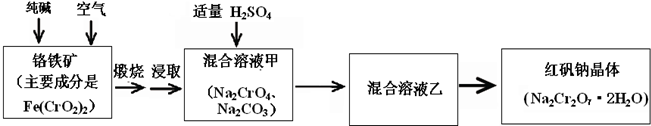
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O?SiO2,则Fe(CrO2)2可写成
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2=2Fe2O3+8Na2CO4+8CO2
为了加快该反应的反应速率,可采取的措施是
(4)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+=Cr2O72-+H2O;
3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是
②混合溶液乙中溶质的化学式是
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72-必须除去.

工业上可用电解法来处理含Cr2O72-的废水,如图为电解装置示意图(电极材料分别为铁和石墨).通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去.
a电极的电极反应式是
实验Ⅰ证明Na2SO3中硫元素的价态能发生
| +4 |
| S |
| +6 |
| S |
(1)实验中,不需要用到的试剂有
A.稀硫酸 B.H2O2溶液 C.稀盐酸 D.淀粉碘化钾溶液 E.BaCl2溶液
观察到的现象是
实验Ⅱ制取硫代硫酸钠晶体
利用如图所示装置进行实验.已知:①硫代硫酸钠能与酸发生反应
②装置d中发生反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2

(2)装置b中发生反应的化学方程式为
(3)装置c的作用是
(4)装置d中的反应结束后,先关闭分液漏斗旋塞,接下来的操作是
实验Ⅲ测定某硫代硫酸钠样品的纯度(设:样品中只含Na2SO3杂质)设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品m g,配制成250mL待测溶液.
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na2SO3与I2反应)和少量淀粉溶液,用n mol?L-1 I2标准溶液滴定(发生反应:2S2O32-+I2=S4O62-+2I-),至滴定终点.
(5)②中消耗I2标准溶液VmL,样品中Na2S2O3的百分含量为
| 3.16nv |
| m |
| 3.16nv |
| m |
(6)该实验方案存在的一个明显缺陷是