网址:http://m.1010jiajiao.com/timu3_id_398118[举报]
(16分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl23.O mol·L-1、FeCl3 1.0 mol·L-1、HCl3.0 mol·L-1。取废腐蚀液200mL按如下流程在实验室进行实验:

回答下列问题:
① 废腐蚀液中加入过量铁粉后,发生反应的离子方程式为 。
② 检验废腐蚀液中含有Fe3+的实验操作是 ;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、 。
③由滤渣得到纯铜,除杂所需试剂是 。
(2)某化学兴趣小组利用下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。

①实验开始前,某同学对实验装置进行了气密性检查,方法是 。
②浓盐酸与二氧化锰反应的化学方程式为 ;
烧杯中NaOH溶液的作用是 。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于 g,
需通入Cl2的物质的量应不少于 mol.
查看习题详情和答案>>
(16分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl23.O mol·L-1、FeCl3 1.0 mol·L-1、HCl3.0 mol·L-1。取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
废腐蚀液中加入过量铁粉后,发生反应的离子方程式为 。
②检验废腐蚀液中含有Fe3+的实验操作是 ;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、 。
③由滤渣得到纯铜,除杂所需试剂是 。
(2)某化学兴趣小组利用下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
①实验开始前,某同学对实验装置进行了气密性检查,方法是 。
②浓盐酸与二氧化锰反应的化学方程式为 ;
烧杯中NaOH溶液的作用是 。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于 g,
需通入Cl2的物质的量应不少于 mol.
(16分)已知:RCH=CH2 RCH2COOH,下图表示有机物A、B、C、D、E、F、X、Y之间的转变关系:
RCH2COOH,下图表示有机物A、B、C、D、E、F、X、Y之间的转变关系:

其中:X、Y互为同分异构体,F和C互为同系物,E和D互为同系物,B中含支链,且核磁共振氢谱测得有3个吸收峰,峰高6:1:1;A的密度在标准状况下为1.25g/L;A、B、X、Y的分子式都符合CnH2nO0. 5n-1
(1)B的结构简式为 ,Y的结构简式为
(2)C和D生成X的化学反应类型为
A、加成反应 B、消去反应
C、取代反应 D、酯化反应
(3)实验室制取A的化学反应方程式为 ;
(4)实验室组装A的发生装置时,用到的玻璃仪器主要有酒精灯、导气管
(5)收集A的装置是 (填序号)
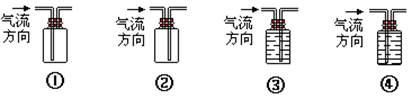
(6)实验室制取A时,常因温度过高而生成有刺激性气味的气体e,设计一个简单的实验以验证发生装置中生成的A有还原性,可使产生气体依次通过下列溶液中的一种或几种,则所选试剂的顺序为 (填序号,可不全选,也可以重复使用)
①品红溶液 ②溴水
③氢氧化钠溶液 ④酸性高锰酸钾溶液
查看习题详情和答案>>
(16分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示): ;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp
= 1.8×10-10 ;25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL 0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是
(填写序号);②中氯离子的浓度为
mol·L-1。
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp
= 1.8×10-10 ;25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL 0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是
(填写序号);②中氯离子的浓度为
mol·L-1。
查看习题详情和答案>>
【16分】今有某学生设计的用催化氧化法制取少量HNO3溶液的实验装置,如下图所示。
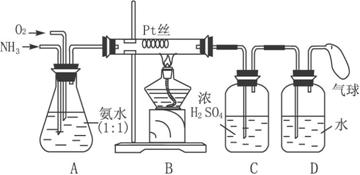
请回答下列问题。
(1)实验室制备NH3,下列方法中宜选用的是________(填序号)
①固态氯化铵与熟石灰混合加热
②固态氯化铵加热分解
③生石灰中滴加浓氨水
④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为______________;在实验过程中,加热Pt丝红热后,移去酒精灯,发现Pt丝还继续保持红热,由此可判断该反应是_____________________。
(3)装置C的作用是__________;装置C中的现象是__________;为确保D中尽可能多生成HNO3,所通入O2和NH3的体积比应大于__________。
(4)氨在高温下催化氧化时还有副反应发生:4NH3+3O2![]() 2N2+6H2O。若忽略装置中残留的气体体积,测得D中有1.0 mol·L-1的HNO3溶液150 mL,气球中收集的混合气体体积为400 mL(标准状况),其中NO2、O2与N2的体积比为2∶2∶1,则氧化成NO的氨占被氧化的体积分数为_________。
2N2+6H2O。若忽略装置中残留的气体体积,测得D中有1.0 mol·L-1的HNO3溶液150 mL,气球中收集的混合气体体积为400 mL(标准状况),其中NO2、O2与N2的体积比为2∶2∶1,则氧化成NO的氨占被氧化的体积分数为_________。