摘要:不溶于水的氧化亚铜可溶于含硫酸铁的硫酸溶液中.这时生成的硫酸亚铁可用酸性高锰酸钾溶液滴定.从而测定氧化亚铜的量:Cu2O+Fe2(SO4)3+H2SO4--FeSO4+CuSO4+H2O FeSO4+KMnO4+H2SO4--Fe2(SO4)3+MnSO4+K2SO4+H2O 由上述反应知,0.1mol/L的KMnO4溶液1mL相当于氧化亚铜的量是 A. 360mg B. 3.6g C. 0.36g D. 2.5×10-4mol
网址:http://m.1010jiajiao.com/timu3_id_397986[举报]
不溶于水的氧化亚铜可溶于含硫酸铁的硫酸溶液中,这时生成的硫酸亚铁可用酸性高锰酸钾溶液滴定,从而测定氧化亚铜的量:
Cu2O+Fe2(SO4)3+H2SO4→FeSO4+CuSO4+H2O
FeSO4+KMnO4+H2SO4→Fe2(SO4)3+MnSO4+K2SO4+H2O
由上述反应知;0.1mol/L的KMnO4溶液1mL相当于氧化亚铜的量是
Cu2O+Fe2(SO4)3+H2SO4→FeSO4+CuSO4+H2O
FeSO4+KMnO4+H2SO4→Fe2(SO4)3+MnSO4+K2SO4+H2O
由上述反应知;0.1mol/L的KMnO4溶液1mL相当于氧化亚铜的量是
[ ]
A.360mg
B.3.6g
C.0.36g
D.2.5×10-4mol
查看习题详情和答案>>
B.3.6g
C.0.36g
D.2.5×10-4mol
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色.已知pH为5时,+2价铜已开始以碱式盐的形式沉淀.某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:

(1)加入的A是
(2)反应②的离子方程式是
(3)保持各反应物的最佳配比,改变温度,测得Cu2Cl2产率的变化如图二所示.则溶液温度控制在
查看习题详情和答案>>

(1)加入的A是
稀硫酸
稀硫酸
,通入的B是空气
空气
.(2)反应②的离子方程式是
2Cu2++SO32-+2Cl-+H2O=Cu2Cl2↓+SO4-+2H+
2Cu2++SO32-+2Cl-+H2O=Cu2Cl2↓+SO4-+2H+
.为提高Cu2Cl2的产率,常在反应②的溶液中加适量稀碱溶液,控制pH为3.5.这样做的目的是OH-中和了反应生成的H+,有利于反应向右进行,提高Cu2Cl2的产率
但当OH-浓度偏大时,Cu2+能与OH结合,生成沉淀,反而降低了Cu2Cl2的产率造成产物不纯
但当OH-浓度偏大时,Cu2+能与OH结合,生成沉淀,反而降低了Cu2Cl2的产率造成产物不纯
OH-中和了反应生成的H+,有利于反应向右进行,提高Cu2Cl2的产率
但当OH-浓度偏大时,Cu2+能与OH结合,生成沉淀,反而降低了Cu2Cl2的产率造成产物不纯
.但当OH-浓度偏大时,Cu2+能与OH结合,生成沉淀,反而降低了Cu2Cl2的产率造成产物不纯
(3)保持各反应物的最佳配比,改变温度,测得Cu2Cl2产率的变化如图二所示.则溶液温度控制在
53℃~55℃
53℃~55℃
时,Cu2Cl2的产率已达到94%,当温度高于65℃时,Cu2Cl2产率会下降,其原因可能是温度过高,促进了CuCl2的水解
温度过高,促进了CuCl2的水解
.氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂.以粗盐水(含Ca2+、Mg2+、SO2-4等杂质).Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:
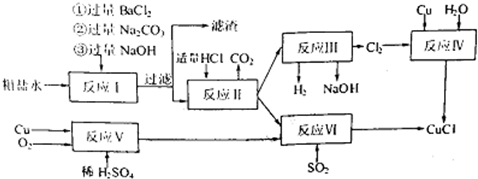
(1)反应Ⅰ中加Na2CO3溶液的作用是 .
(2)反应Ⅱ在电解条件下进行,电解时阳极发生的电极反应可表示为 .
(3)写出反应Ⅵ的化学方程式 .
(4)反应Ⅳ加入的Cu必须过量,其目的是 .
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品.于70℃真空干燥的目的是 .
查看习题详情和答案>>

(1)反应Ⅰ中加Na2CO3溶液的作用是
(2)反应Ⅱ在电解条件下进行,电解时阳极发生的电极反应可表示为
(3)写出反应Ⅵ的化学方程式
(4)反应Ⅳ加入的Cu必须过量,其目的是
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品.于70℃真空干燥的目的是
纳米氧化亚铜(Cu2O)是一种光催化剂,极具太阳能转换潜力.
(1)生成氧化亚铜的反应很多,中学化学涉及的反应之一是乙醛与新制的氢氧化铜反应,该反应的化学方程为: .
(2)目前常用微乳液-还原法:在100℃,将0.5g十二烷基苯磺酸钠溶解于100mL、0 1mol/L的Cu(NO3)2水溶液中,再快速加入一定体积5mol/L的NaOH水溶液,并搅拌使之混合均匀,再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O粉末.
①已知:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-akJ/mol
Cu(OH)2(s)═CuO(s)+H2O(l)△H=bkJ/mol
4CuO(s)═2Cu2O(s)+O2(g)△H=ckJ/mol
则4Cu(OH)2(s)+N2H4(l)═2Cu2O(s)+N2(g)+6H2O(l)△H= kJ/mol.
②十二烷基苯磺酸钠是洗衣粉的主要成分,它在该法中可能的作用是 .
(3)用铜棒作阳极,钛作阴极,电解氯化钠和氢氧化钠的混合溶液,电解总方程为:2Cu+H2O
Cu2O+H2↑,纳米氧化亚铜在 极获得.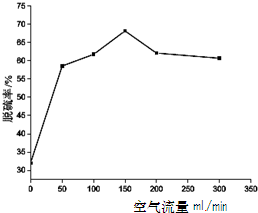
(4)在石化工业中常用纳米Cu2O光解脱硫时,在反应容器中加入一定量含硫混合物[噻吩(C4H4S)和正辛烷按物质的量1:1]并加入0.1g纳米Cu2O,光照同时通入空气1h,分别测定不同流速下最后剩余液中硫的质量分数确定脱硫率,所得结果如右图,下列说法正确的是 .
A.用正辛烷作溶剂进行实验,是为了模拟柴油的成分
B.用噻吩作含硫化合物是研究有机硫的去除率
C.该实验条件下,空气的流量以150mL/min左右为宜
D.当空气流量超过150mL/min脱硫率下降主要是因为氧化亚铜挥发.
查看习题详情和答案>>
(1)生成氧化亚铜的反应很多,中学化学涉及的反应之一是乙醛与新制的氢氧化铜反应,该反应的化学方程为:
(2)目前常用微乳液-还原法:在100℃,将0.5g十二烷基苯磺酸钠溶解于100mL、0 1mol/L的Cu(NO3)2水溶液中,再快速加入一定体积5mol/L的NaOH水溶液,并搅拌使之混合均匀,再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O粉末.
①已知:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-akJ/mol
Cu(OH)2(s)═CuO(s)+H2O(l)△H=bkJ/mol
4CuO(s)═2Cu2O(s)+O2(g)△H=ckJ/mol
则4Cu(OH)2(s)+N2H4(l)═2Cu2O(s)+N2(g)+6H2O(l)△H=
②十二烷基苯磺酸钠是洗衣粉的主要成分,它在该法中可能的作用是
(3)用铜棒作阳极,钛作阴极,电解氯化钠和氢氧化钠的混合溶液,电解总方程为:2Cu+H2O
| ||

(4)在石化工业中常用纳米Cu2O光解脱硫时,在反应容器中加入一定量含硫混合物[噻吩(C4H4S)和正辛烷按物质的量1:1]并加入0.1g纳米Cu2O,光照同时通入空气1h,分别测定不同流速下最后剩余液中硫的质量分数确定脱硫率,所得结果如右图,下列说法正确的是
A.用正辛烷作溶剂进行实验,是为了模拟柴油的成分
B.用噻吩作含硫化合物是研究有机硫的去除率
C.该实验条件下,空气的流量以150mL/min左右为宜
D.当空气流量超过150mL/min脱硫率下降主要是因为氧化亚铜挥发.