网址:http://m.1010jiajiao.com/timu3_id_397769[举报]
(10分)某学生探究过氧化钠与水反应时,取一定量的过氧化钠固体置于试管中,加水使其充分反应至不再产生气体为止,将所得溶液分为两份分别置于甲.乙两试管,再进行下列实验。
实验一:向甲试管中滴入几滴酚酞试液,溶液先变红后褪色;
实验二:向乙试管加入少许MnO2并微热有大量气体产生,待无气体产生后,滴入几滴酚酞试液,溶液变红,但持久不褪色;再向该溶液中滴入2mol/L H2SO4溶液酸化,溶液红色褪去,且产生少量气体。
资料卡片:Na2O2可看作二元弱酸H2O2对应的盐。
请回答下列问题:
(1)过氧化钠第一步水解的离子方程式为 。
(2)实验一中使溶液红色褪去的物质是________________。
(3)实验二中H2SO4酸化后反应的化学方程式_ _________ _._______________ 。
(4)从反应原理角度看,过氧化钠与水反应的氧化产物是氧气,还原产物应是____。
A.H2O2 B.H2O C.NaOH D.NaHO2
查看习题详情和答案>>(14分)过氧化钠常用做漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易变质。
(1)某课外活动小组欲探究一包过氧化钠样品是否已经变质:
取少量样品,溶解,加入_______溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是_______。
②写出装置C中发生反应的化学方程式:_______。
③实验结束时,在读取实验中生成气体的体积时,你认为合理的是_______ (填选项编号)。
a.直接读取气体体积,不需冷却到室温
b.调整量筒内外液面高度使之相同
c.视线与凹液面的最低点相平读取量筒中水的体积
④读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为_______。
⑤本实验方案存在的缺陷是_______。
查看习题详情和答案>>
过氧化钠常用做漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易变质。
(1)某课外活动小组欲探究一包过氧化钠样品是否已经变质:取少量样品溶解,加入_______溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
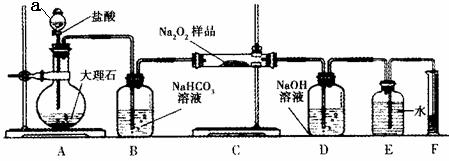
① 装置中仪器a的名称是 。
② 将仪器连接好以后,必须进行的第一步操作是_______。
③ 写出装置C中发生反应的化学方程式_______。
④ 实验结束时,在读取实验中生成气体的体积时,你认为合理的是_______ (填选项编号)。
a.直接读取气体体积,不需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为_______。
查看习题详情和答案>>(1)某课外活动小组欲探究一包过氧化钠样品是否已经变质:
取少量样品,溶解,加入_______溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是_______。
②写出装置C中发生反应的化学方程式:_______。
③实验结束时,在读取实验中生成气体的体积时,你认为合理的是_______ (填选项编号)。
a.直接读取气体体积,不需冷却到室温
b.调整量筒内外液面高度使之相同
c.视线与凹液面的最低点相平读取量筒中水的体积
④读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为_______。
⑤本实验方案存在的缺陷是_______。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是_______。(填序号)
A. 铝与Cl--反应,铝与SO42--不反应
B. 氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C. 硫酸铜水解生成硫酸使铝钝化
D. 氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E. 生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是_______。
(3)放出的气体是_______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是_______。
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_______。
A. 用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B. 把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C. 向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D. 在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下: