网址:http://m.1010jiajiao.com/timu3_id_3976479[举报]
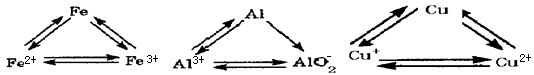
(1)氮化铝是一种性能良好的高温结构陶瓷,它的电子式:_________; 铁在周期表中的位置:_____________;
(2)铜生成铜绿是生活中常见的现象,其反应原理用方程式表示:_________; 氢氧化铝被称为两性氢氧化物,写出其酸式电离方程式:__________________;
(3)高铁酸盐被科学家们公认为绿色消毒剂, 它可以通过如下途径制备:次氯酸盐氧化法制备:采用次氯酸盐氧化法,在10.00 mL质量分数为8%的次氯酸钠溶液中加入5.5 g氢氧化钠和0.70 g硫酸铁,可制备摩尔浓度(物质的量浓度)为0.01 mol/L的高铁酸钠,写出制备的离子方程式: __________________高铁酸钠不仅可以消毒,也可以作净水剂,陈述理由:__________________
(4)燃料电池如图所示,写出石墨(I)电极上发生的电极反式:__________________ 。以此燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4 溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为_____________.。




B.通常人们把由不到20个单糖缩合形成的糖类化合物称为低聚糖,那么低聚糖彻底水解后将得到单糖。
C.许多蛋白质在水中有一定的溶解性,溶于水形成胶体后,再加入浓的硫酸钠溶液会破坏这种胶体结构而导致蛋白质变性,并有沉淀析出。
D.李比希法、钠融法、铜丝燃烧法、元素分析仪均可帮助人们确定有机化合物的元素组成和空间结构。
CH3CH2OH、CH3COOH和NaOH都是中学化学的常用试剂。请回答下列问题:
⑴①乙酸和甲酸甲酯互为同分异构体,但前者的熔点高于后者。原因是 。
②在油脂的皂化反应中,加入乙醇能加快反应的速率。原因是 。
③将在空气中灼烧成红热的铜丝伸入无水乙醇中,铜丝立即变为红色。请用化学方程式表示铜丝变红的原因 。
⑵用0.1mol/LNaOH溶液测定CH3COOH的物质的量浓度,碱式滴定管用标准溶液润洗后即加入标准溶液,经“必要”操作后,进行滴定。
①此处的“必要”操作是指 。
②选用的指示剂是 。
③滴点终点时溶液中离子浓度由大到小的顺序是 。
⑶无水醋酸钠和NaOH固体混合加热时能生成CH4,反应的化学方程式是 ,利用此反应制备CH4的装置与制备 相同。
⑷乙醇和乙酸在浓硫酸存在下反应生成具有香味的物质,反应的化学方程式是 。反应类型是 ,用浓硫酸作催化剂可能造成 等问题(答两条即可)。
查看习题详情和答案>>CH3CH2OH、CH3COOH和NaOH都是中学化学的常用试剂。请回答下列问题:
⑴①乙酸和甲酸甲酯互为同分异构体,但前者的熔点高于后者。原因是 。
②在油脂的皂化反应中,加入乙醇能加快反应的速率。原因是 。
③将在空气中灼烧成红热的铜丝伸入无水乙醇中,铜丝立即变为红色。请用化学方程式表示铜丝变红的原因 。
⑵用0.1mol/LNaOH溶液测定CH3COOH的物质的量浓度,碱式滴定管用标准溶液润洗后即加入标准溶液,经“必要”操作后,进行滴定。
①此处的“必要”操作是指 。
②选用的指示剂是 。
③滴点终点时溶液中离子浓度由大到小的顺序是 。
⑶无水醋酸钠和NaOH固体混合加热时能生成CH4,反应的化学方程式是 ,利用此反应制备CH4的装置与制备 相同。
⑷乙醇和乙酸在浓硫酸存在下反应生成具有香味的物质,反应的化学方程式是 。反应类型是 ,用浓硫酸作催化剂可能造成 等问题(答两条即可)。
查看习题详情和答案>>
CH3CH2OH、CH3COOH和NaOH都是中学化学的常用试剂。请回答下列问题:
⑴①乙酸和甲酸甲酯互为同分异构体,但前者的熔点高于后者。原因是 。
②在油脂的皂化反应中,加入乙醇能加快反应的速率。原因是 。
③将在空气中灼烧成红热的铜丝伸入无水乙醇中,铜丝立即变为红色。请用化学方程式表示铜丝变红的原因 。
⑵用0.1mol/LNaOH溶液测定CH3COOH的物质的量浓度,碱式滴定管用标准溶液润洗后即加入标准溶液,经“必要”操作后,进行滴定。
①此处的“必要”操作是指 。
②选用的指示剂是 。
③滴点终点时溶液中离子浓度由大到小的顺序是 。
⑶无水醋酸钠和NaOH固体混合加热时能生成CH4,反应的化学方程式是 ,利用此反应制备CH4的装置与制备 相同。
⑷乙醇和乙酸在浓硫酸存在下反应生成具有香味的物质,反应的化学方程式是 。反应类型是 ,用浓硫酸作催化剂可能造成 等问题(答两条即可)。