网址:http://m.1010jiajiao.com/timu3_id_397608[举报]
 某化学兴趣小组为探究
某化学兴趣小组为探究
铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整.
(2)实验中他们取6.4g铜片和12ml 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①请写铜跟浓硫酸反应的化学方程式:______.
②为什么有一定量的余酸但未能使用铜片完全溶解,你认为原因是:______.
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是______(填写字母编号).
A、铁粉 B、BaCl2溶液 C、银粉 D、Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两同学进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度.他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______ (填写字母编号).
A、将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B、将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C、用排水法测定装置A产生气体的体积(已折算成标准状况)
D、用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
②乙同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,用标准氢氧化钠溶液进行滴淀(已知:Cu(OH)2开始沉淀的pH约为5),能否通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度______(填“能”或“否”),其理由是______.
查看习题详情和答案>>
铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整.
(2)实验中他们取6.4g铜片和12ml 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①请写铜跟浓硫酸反应的化学方程式:______.
②为什么有一定量的余酸但未能使用铜片完全溶解,你认为原因是:______.
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是______(填写字母编号).
A、铁粉 B、BaCl2溶液 C、银粉 D、Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两同学进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度.他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______ (填写字母编号).
A、将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B、将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C、用排水法测定装置A产生气体的体积(已折算成标准状况)
D、用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
②乙同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,用标准氢氧化钠溶液进行滴淀(已知:Cu(OH)2开始沉淀的pH约为5),能否通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度______(填“能”或“否”),其理由是______.

(11分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:

(1)实验中他们取6.4g铜片和12mL 18mol?L![]() 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:______________________________。
②下列药品中能够用来证明反应结束后烧瓶中确有余酸的是 (填编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
③为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是: 。
(2)甲学生设计测定余酸的物质的量浓度的实验方案是测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,下列实验方案中不可行的是_____ __(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将产生的气体缓缓通入足量酸性KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(标准状况下)
D.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(标准状况下)
(3)乙学生设计测定余酸的物质的量浓度的实验方案是:测定反应后混合溶液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100mL,加入足量Na2S溶液,充分反应后过滤,再将沉淀洗涤、干燥、称量。
请写出生成沉淀的离子方程式:
(4)图中C是尾气处理装置,但常常产生倒吸现象,请你设计实验装置,防止倒吸现象的发生,在右图中补充完整:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 1 | 2 | 3 | 4 | 5 | |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
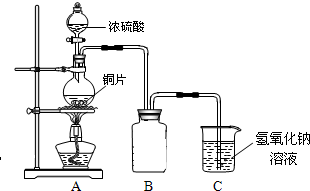 (2011?绵阳模拟)某化学兴趣小组为探究
(2011?绵阳模拟)某化学兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整.
(2)实验中他们取6.4g铜片和12ml 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①请写铜跟浓硫酸反应的化学方程式:
| ||
| ||
②为什么有一定量的余酸但未能使用铜片完全溶解,你认为原因是:
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是
A、铁粉 B、BaCl2溶液 C、银粉 D、Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两同学进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度.他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是
A、将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B、将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C、用排水法测定装置A产生气体的体积(已折算成标准状况)
D、用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
②乙同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,用标准氢氧化钠溶液进行滴淀(已知:Cu(OH)2开始沉淀的pH约为5),能否通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度