摘要:我们已经知道空气的主要成分是氮气和氧气.图为测定空气中氧气含量的实验示意图. ① 实验中.燃烧匙里要盛过量的红磷的原因是? ② 这个实验除了可以得出氧气约占空气体积的1/5的后论外.还可得出氮气 . . 性质. ③证明生成的白色固体溶于水后的溶液呈酸性的方法是 :
网址:http://m.1010jiajiao.com/timu3_id_3975526[举报]
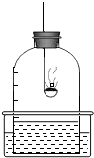 我们已经知道空气的主要成分是氮气和氧气,如图所示为测定空气中氧气含量的实验示意图.
我们已经知道空气的主要成分是氮气和氧气,如图所示为测定空气中氧气含量的实验示意图.(1)实验中,燃烧匙里为什么要盛过量的红磷?
(2)这个实验除了可以得出氧气约占空气体积
| 1 | 5 |
(3)如何证明生成的白色固体溶于水后的溶液呈酸性?
 我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.
我们已经知道空气的主要成分是氮气和氧气,图为测定空气中氧气含量的实验装置示意图.(1)实验时,燃烧匙里的红磷为什么要过量?
使集气瓶中的氧气充分耗尽
使集气瓶中的氧气充分耗尽
.(2)液面上升大约
| 1 |
| 5 |
| 1 |
| 5 |
(3)用上述实验装置测定的空气中氧气含量与正常值有较明显的偏差,其操作上的原因可能是:
装置漏气
装置漏气
,红磷量不足
红磷量不足
.(4)这个实验除了可以得出氧气所占空气体积分数的结论外,还可以得出氮气的哪两条性质?
难溶于水
难溶于水
、不燃烧不支持燃烧
不燃烧不支持燃烧
.(5)若将红磷换成碳粉,则实验应怎样改进可得到准确的结果?
预先在集气瓶内盛入少量氢氧化钠溶液
预先在集气瓶内盛入少量氢氧化钠溶液
.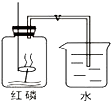 我们已经知道空气的主要成分是氮气和氧气,如图是为了测定空气中氧气含量设定的实验示意图:
我们已经知道空气的主要成分是氮气和氧气,如图是为了测定空气中氧气含量设定的实验示意图:(1)实验时,燃烧匙里为什么要盛放过量的红磷?
为了保证将集气瓶中的氧气完全消耗掉
为了保证将集气瓶中的氧气完全消耗掉
(2)这个实验除了得到氧气约占空气体积五分之一的结论外,还可以得出有关氮气性质的结论是
氮气不溶于水(或不燃烧不支持燃烧)
氮气不溶于水(或不燃烧不支持燃烧)
.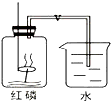 我们已经知道空气的主要成分是氮气和氧气,如图是为了测定空气中氧气含量设定的实验示意图:
我们已经知道空气的主要成分是氮气和氧气,如图是为了测定空气中氧气含量设定的实验示意图: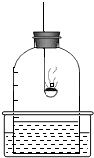 我们已经知道空气的主要成分是氮气和氧气,如图所示为测定空气中氧气含量的实验示意图.
我们已经知道空气的主要成分是氮气和氧气,如图所示为测定空气中氧气含量的实验示意图. 的结论外,还可以得出有关氮气性质的哪些结论?______.
的结论外,还可以得出有关氮气性质的哪些结论?______.