网址:http://m.1010jiajiao.com/timu3_id_39728[举报]
(12分)四川盛产五倍子。以五倍子为原料可以制得化合物A。A的结构简式如下图所示:

请回答下列问题:
(1)A中有哪些官能团(写出名称)___ ______。
(2)有机物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式___ ___。
(3)1molA最多能消耗 molNaOH;请写出A与过量的NaOH溶液反应的化学方程式____ __ ___。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看做是B与氢气按物质的量之比1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能使溴水褪色。请写出C与溴水反应的化学方程式___ ______。
查看习题详情和答案>>
(1)写出反应的化学方程式。
(2)下图是一个学生设计的实验装置图。

这个装置中有哪些错误?请分别指出:
①_______________________________________;
②_______________________________________;
③_______________________________________;
④_______________________________________;
⑤_______________________________________。
(有几处填几处)
(3)在改正的装置中,①洗气瓶中的H2O、②浓H2SO4、③烧杯中的NaOH溶液各起什么作用?
查看习题详情和答案>>(12分)四川盛产五倍子。以五倍子为原料可以制得化合物A。A的结构简式如下图所示: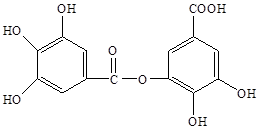
请回答下列问题:
(1)A中有哪些官能团(写出名称)___ ______。
(2)有机物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式___ ___。
(3)1molA最多能消耗 molNaOH;请写出A与过量的NaOH溶液反应的化学方程式____ __ ___。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看做是B与氢气按物质的量之比1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能使溴水褪色。请写出C与溴水反应的化学方程式___ ______。
操作步骤 | 实验现象 | 实验结论及有关反应的离子方程式 |
①取少量溶液于一试管中,加入镁粉 | 有无色可燃性气体生成 |
|
②在一试管中取少量溶液,加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
|
③在一试管中取少量溶液,加入NaBr粉末少许及少量CCl4,振荡 | CCl4层由无色变为橙红色 |
|
④将蓝色布条投入该溶液中 | 布条蓝色褪去 |
|
根据以上事实,完成下列问题:
(1)该物质溶液中有哪些分子及离子________________________________________________。
(2)向该物质溶液中加入紫色石蕊试液,先见石蕊变红,后红色又褪去,其原因是________
____________________________________________________________________。
查看习题详情和答案>>