网址:http://m.1010jiajiao.com/timu3_id_3968286[举报]
 (1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
(1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)①
③
(2)欲使反应更快进行,应向小烧杯中加入
(3)用该装置做铜与浓硝酸反应的实验,最突出的优点是
(4)若要验证最终得到的气体中是否有NO,最简便的方法是
(5)工业上吸收NO和NO2的混合气体,常使用NaOH溶液.欲使NO和NO2被充分吸收,则NO和NO2的体积应满足
(NO+NO2+2NaOH=2NaNO2+H2O)
a.V(NO)>V(NO2) b.V(NO)<V(NO2) c.V(NO)≤V(NO2)
(9分)㈠如图是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元)。晶体中氧的化合价可看作是部分为0价,部分为-2价。
⑴该结构与 的结构相似(填选项字母,下同)
A.NaCl B.CsCl C.干冰 D.SiO2
⑵钾、氧两元素所形成化合物的化学式是
A.K2O B.K2O2 C.K2O3 D.KO2
⑶下列对KO2晶体结构的描述正确的是
A.晶体中与每个K+距离最近的K+有8个
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.每个 O2-周围最近且等距离的K+所围成的空间构型为正八面体
D.晶体中,0价氧原子与-2价氧原子的数目比为3: 1
㈡如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解池,其电极材料见右图:
⑴关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为 极,通电一段时间后,观察到滤纸d端的电极反应式是 ;
⑵已知C装置中溶液为Cu(NO3)2和Y(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。
则Cu2+、Y3+、H+氧化能力由大到小的顺序是 ;D装置中溶液是H2SO4,则电极C端的实验现象是_____ 。
(9分)㈠如图是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元)。晶体中氧的化合价可看作是部分为0价,部分为-2价。

⑴该结构与 的结构相似(填选项字母,下同)
A.NaCl B.CsCl C.干冰 D.SiO2
⑵钾、氧两元素所形成化合物的化学式是
A.K2O B.K2O2 C.K2O3 D.KO2
⑶下列对KO2晶体结构的描述正确的是
A.晶体中与每个K+距离最近的K+有8个
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.每个 O2-周围最近且等距离的K+所围成的空间构型为正八面体
D.晶体中,0价氧原子与-2价氧原子的数目比为3: 1
㈡如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解池,其电极材料见右图:

⑴关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为 极,通电一段时间后,观察到滤纸d端的电极反应式是 ;
⑵已知C装置中溶液为Cu(NO3)2和Y(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。

则Cu2+、Y3+、H+氧化能力由大到小的顺序是 ;D装置中溶液是H2SO4,则电极C端的实验现象是_____ 。
查看习题详情和答案>>
(1)以天然气为原料制H2是合成氨的一条重要的路线.甲烷的部分氧化,其反应式如下:
①CH4(g)+1/2O2 (g)=CO (g)+2H2(g)△H1=-35.6kJ?molˉ1
试判断常温下,上述反应能否自发进行______(填“能”或“否”),有研究认为甲烷部分氧化的机理为:
②CH4(g)+2O2 (g)=CO 2(g)+2H2O(g)△H2=-890.3kJ?molˉ1
③CH4(g)+CO2 (g)=2CO (g)+2H2(g)△H3=247.3kJ?molˉ1
试结合反应①,确定下面热化学反应方程式中的△H值
CH4(g)+H2O (g)=CO (g)+3H2(g)△H=______kJ?molˉ1
(2)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?Lˉ1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

此条件下,该反应达到化学平衡时,氮气的浓度为______.
(3)希腊亚里斯多德大学的Marmellos和Stoukides用一种特殊的电解方法合成氨.即在常压下把氢气和用氦气稀释的氮气,分别通入到570℃的电解池中,用高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯多晶薄膜做电极,转化率高达78%.其实验装置如右图.阴极的电极反应式______.
(4)用标准盐酸标定某氨水的浓度时应该选择下列哪种指示剂最好______.
A.甲基橙 B.石蕊 C.酚酞
(Ⅱ) pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10ˉ3mol?Lˉ1,则pC=-lg(1×10ˉ3)=3.某温度下,H2CO3溶液的pC-pH关系如图.
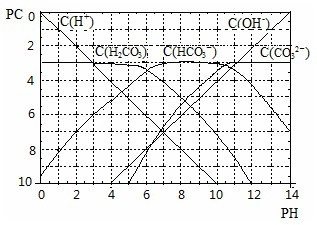
请回答下列问题:
(1)pH=2~4时,H2CO3溶液中主要存在的离子为______;
(2)求此温度下H2CO3

H++HCO3ˉ 的电离平衡常数______;
(3)能够抵抗外来少量酸碱的影响、保持自身 pH变化不大的溶液,称之为缓冲溶液.如浓度均为0.1mol?Lˉ1的NaHCO3和Na2CO3混合溶液就是一种缓冲溶液,加入少量酸或碱,由于平衡HCO3ˉ

H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液______.
(1)以天然气为原料制H2是合成氨的一条重要的路线.甲烷的部分氧化,其反应式如下:
①CH4(g)+1/2O2 (g)=CO (g)+2H2(g)△H1=-35.6kJ?molˉ1
试判断常温下,上述反应能否自发进行 (填“能”或“否”),有研究认为甲烷部分氧化的机理为:
②CH4(g)+2O2 (g)=CO 2(g)+2H2O(g)△H2=-890.3kJ?molˉ1
③CH4(g)+CO2 (g)=2CO (g)+2H2(g)△H3=247.3kJ?molˉ1
试结合反应①,确定下面热化学反应方程式中的△H值
CH4(g)+H2O (g)=CO (g)+3H2(g)△H= kJ?molˉ1
(2)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
(3)希腊亚里斯多德大学的Marmellos和Stoukides用一种特殊的电解方法合成氨.即在常压下把氢气和用氦气稀释的氮气,分别通入到570℃的电解池中,用高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯多晶薄膜做电极,转化率高达78%.其实验装置如右图.阴极的电极反应式 .
(4)用标准盐酸标定某氨水的浓度时应该选择下列哪种指示剂最好 .
A.甲基橙 B.石蕊 C.酚酞
(Ⅱ) pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10ˉ3mol?Lˉ1,则pC=-lg(1×10ˉ3)=3.某温度下,H2CO3溶液的pC-pH关系如图.

请回答下列问题:
(1)pH=2~4时,H2CO3溶液中主要存在的离子为 ;
(2)求此温度下H2CO3
 H++HCO3ˉ 的电离平衡常数 ;
H++HCO3ˉ 的电离平衡常数 ;(3)能够抵抗外来少量酸碱的影响、保持自身 pH变化不大的溶液,称之为缓冲溶液.如浓度均为0.1mol?Lˉ1的NaHCO3和Na2CO3混合溶液就是一种缓冲溶液,加入少量酸或碱,由于平衡HCO3ˉ
 H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液 .
H++CO32ˉ移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液 . 查看习题详情和答案>>
查看习题详情和答案>>