摘要:如图所示为水的电解装置.回答下列问题: (1)在图中用+ .“- 标出电源的正极.负极 (2)A管内产生的气体能 燃烧 .B管产生的气体能 助燃 , (3)写出水电解的文字表示式: 水 氢气+氧气
网址:http://m.1010jiajiao.com/timu3_id_3965723[举报]
如图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
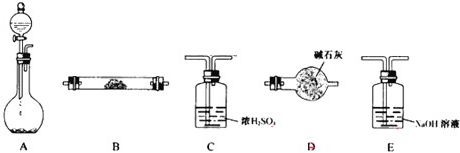
(1)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3.能产生大量NH3的原因是:
a.Na2O2与水反应,使溶剂减少,降低NH3的溶解量,使氨气逸出;
b.Na2O2与水反应,放热,使氨气逸出;
c.
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:A→
(2)若烧瓶中盛装X g Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2还原性并检验H2的氧化产物,仪器连接顺序A→C→B→B→D时,两次使用B装置,第一个B装置中反应的化学方程式为
②上述实验中如果使用的是纯锌,反应速度往往较慢,为了加快H2产生的速率可采取的方法有
a、将烧瓶放入热水中.b、将稀H2SO4改为浓H2SO4.c、在稀H2SO4溶液中滴入少量CuSO4.d、在稀H2SO4中加入少量固体NaCl.
③若锌片不纯(杂质不与稀H2SO4反应),稀H2SO4及B装置中固体足量,反应后测得第一个B装置质量的变化Y g,则锌片纯度为
.
查看习题详情和答案>>

(1)若烧瓶中盛装Na2O2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O2外,还能产生大量NH3.能产生大量NH3的原因是:
a.Na2O2与水反应,使溶剂减少,降低NH3的溶解量,使氨气逸出;
b.Na2O2与水反应,放热,使氨气逸出;
c.
Na2O2与水反应生成OH-,c(OH-)增大,抑制NH3?H2O的电离,有利于NH3的逸出
Na2O2与水反应生成OH-,c(OH-)增大,抑制NH3?H2O的电离,有利于NH3的逸出
;②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:A→
D
D
→B
B
→E
E
.(2)若烧瓶中盛装X g Zn片,分液漏斗中盛装稀H2SO4,则:
①当制备H2、验证H2还原性并检验H2的氧化产物,仪器连接顺序A→C→B→B→D时,两次使用B装置,第一个B装置中反应的化学方程式为
H2+CuO
H2O+Cu
| ||
H2+CuO
H2O+Cu
、第二个B装置中所盛的药品是
| ||
无水CuSO4
无水CuSO4
;D装置的作用是防止空气中的水进入装置,干扰H2氧化产物的检验
防止空气中的水进入装置,干扰H2氧化产物的检验
.②上述实验中如果使用的是纯锌,反应速度往往较慢,为了加快H2产生的速率可采取的方法有
a、c
a、c
a、将烧瓶放入热水中.b、将稀H2SO4改为浓H2SO4.c、在稀H2SO4溶液中滴入少量CuSO4.d、在稀H2SO4中加入少量固体NaCl.
③若锌片不纯(杂质不与稀H2SO4反应),稀H2SO4及B装置中固体足量,反应后测得第一个B装置质量的变化Y g,则锌片纯度为
| 65Y |
| 16X |
| 65Y |
| 16X |
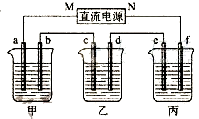 右图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
右图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为
正
正
极;②电极b上发生的电极反应为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
;③列式计算电极b上生成的气体在标准状况下的体积:
2.8L
2.8L
④电极c的质量变化是
16
16
g;⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液
甲增大,因为相当于电解水
甲增大,因为相当于电解水
;乙溶液
乙减小,OH-放电,H+增多
乙减小,OH-放电,H+增多
;丙溶液
丙不变,相当于电解水
丙不变,相当于电解水
;(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
可以,铜全部析出,可以继续电解H2SO4,有电解液即可电解
可以,铜全部析出,可以继续电解H2SO4,有电解液即可电解
.