摘要: 氧化反应:物质与氧发生的化学反应. 燃烧:发光发热的剧烈的氧化反应.可引起爆炸 缓慢氧化:速率缓慢的氧化反应.可引起自燃
网址:http://m.1010jiajiao.com/timu3_id_3961291[举报]
化学反应往往伴随着一些现象发生,如发光、放热、变色、产生沉淀、产生气体等.但CO2与NaOH溶液的反应没有明显的现象.为了通过一些现象说明CO2与NaOH发生了反应,某班同学分两组作了如下探究实验:

(1)第一组同学把一只收集有CO2的试管倒立在装有饱和NaOH溶液的烧杯中,如图1所示看到试管内液面上升.这种现象是因为试管内外产生
(2)第二组同学也得到了启发,也设计了如图2、3、4、5、6所示的实验装置进行探究:你认为以上能达到实验要求的是
(3)同学们经过分析讨论,认为第一组的实验中产生液面上升现象的原因可能有两种.一种是因为CO2与溶液中的NaOH反应,消耗了CO2,你认为另一种原因是
(4)为了进一步证实CO2与NaOH溶液已经发生了反应,甲同学设计了如下方案(如图7):你认为可以说明问题吗?你会看到什么现象
(5)乙同学没有滴加稀盐酸,他加了另一种物质看到的现象是
查看习题详情和答案>>

(1)第一组同学把一只收集有CO2的试管倒立在装有饱和NaOH溶液的烧杯中,如图1所示看到试管内液面上升.这种现象是因为试管内外产生
气压差
气压差
.(2)第二组同学也得到了启发,也设计了如图2、3、4、5、6所示的实验装置进行探究:你认为以上能达到实验要求的是
2、3、4、5、6
2、3、4、5、6
.(3)同学们经过分析讨论,认为第一组的实验中产生液面上升现象的原因可能有两种.一种是因为CO2与溶液中的NaOH反应,消耗了CO2,你认为另一种原因是
二氧化碳和水反应或溶于水
二氧化碳和水反应或溶于水
.(4)为了进一步证实CO2与NaOH溶液已经发生了反应,甲同学设计了如下方案(如图7):你认为可以说明问题吗?你会看到什么现象
能,有气泡生成
能,有气泡生成
.(5)乙同学没有滴加稀盐酸,他加了另一种物质看到的现象是
有沉淀生成
有沉淀生成
,乙同学加的物质是氯化钙(可溶性钙、钡盐)
氯化钙(可溶性钙、钡盐)
.他们看到的现象虽然不同,但都可以证实CO2与NaOH溶液已经发生了反应.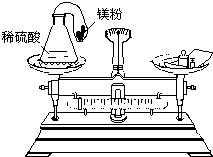 化学反应的实质是原子的重新组合.那么,在一切化学反应前后,物质的总质量是否发生变化呢?针对这一问题,甲、乙、丙三位同学分别做了如下实验探究:
化学反应的实质是原子的重新组合.那么,在一切化学反应前后,物质的总质量是否发生变化呢?针对这一问题,甲、乙、丙三位同学分别做了如下实验探究:学生甲:在一只试管中装入少量红磷,将其置于一烧杯中,称量,并记录数据;然后,用酒精灯加热,点燃红磷,充分反应后,冷却称量.
学生乙:把装有无色氢氧化钠溶液的小试管,小心地放入盛有蓝色硫酸铜溶液的小烧杯中.将小烧杯放到天平上称量.取下小烧杯并将其倾斜,使两种溶液混合,氢氧化钠与硫酸反应,生成蓝色沉淀,再把小烧杯放到天平上称量.
学生丙:设计了如图所示的实验.
请你回答以下问题:
(1)你认为甲、乙、丙三位同学所进行的实验,有错误的是
甲
甲
同学,改进的方法是将试管塞上一个带导管的单孔橡皮塞,导管上系一气球
将试管塞上一个带导管的单孔橡皮塞,导管上系一气球
,目的是使装置密闭
使装置密闭
.(2)学生丙所进行的实验,反应前后天平能平衡吗?
答:
不能
不能
[答能或不能],理由是镁与硫酸反应产生氢气,氢气充满气球,使整个装置所受空气浮力增大.
镁与硫酸反应产生氢气,氢气充满气球,使整个装置所受空气浮力增大.
.(3)若学生丙在实验前称量包括反应容器在内的各物质总质量为135g,请你完成下表以表示他在称量时使用砝码的情况(添加用“↓”表示,从托盘上取下用“↑”表示).
| 砝码 | 100g | 50g | 20g | 20g | 10g | 5g |
| 使用情况 | ↓ | ↓↑ ↓↑ |
↓ ↓ |
↓↑ | ↓ ↓ |
↓ |
化学反应的速率与反应物的浓度之间有一定的规律可循.某实验小组各取等质量的木炭和等质量的硫分别在容积相同的集气瓶中燃烧.记录如下:
| 实验 | 实验步骤 | 实验现象 | 燃烧反应的化学方程式 |
| A | ①硫在空气中燃烧 | ①发出淡蓝色火焰并产生有刺激味气体 | ________ |
| ②硫在氧气中燃烧 | ②________并产生有刺激味气体 | ||
| B | ③铁在空气中燃烧 | ③无法点燃 | ________ |
| ④铁在氧气中燃烧 | ④________并生成黑色固体 |
通过对A、B两组对比实验现象的分析和规纳,可以得出化学反应的速率与反应物的浓度之间的规律是:________.
反思与评价:
(1)在学习“双氧水制取氧气”的实验时,小明发现反应时速率发生了这样的变化:在催化剂二氧化锰后反应速度变快了,并随着反应进行速度越来越快,但一段时间后又变慢了.请你帮助小明说明加入催化剂后速度越来越快的原因________;反应一段时间又变慢的原因________.
(2)除以上讨论的影响反应速率的因素外,还有________影响反应速率的因素. 查看习题详情和答案>>
| 化学反应的程度与反应物的浓度之间有一定的规律可循.某实验小组各取等质量的木炭和等质量的硫分别在容积相同的集气瓶中燃烧. (1)记录如下:②木炭在氧气中燃烧比在空气中燃烧更旺,发出白光,放出更多的热量.木炭燃烧的化学方程式为:___________.④硫在氧气中燃烧发出明亮的蓝紫色火焰,放出更多的热量.硫燃烧的化学方程式为:___________. | |||||||||||||||||||
|
(2)
| |||||||||||||||||||
| (3)通过A、B两组对比实验的现象,可以得出的规律是: ____________________ | |||||||||||||||||||
有的化学反应伴随明显现象,有的化学反应则没有明显现象。某兴趣小组同学为证明NaOH与稀盐酸能发生化学反应,从不同角度设计了如下方案,并进行实验。
(1)方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸并不断振荡,同时测定溶液的pH,若测得溶液的pH____(填序号),则证明NaOH与稀盐酸发生了化学反应。
a.逐渐增大并≥7;b.逐渐减小并≤7;c.始终不变并等于7
(1)方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸并不断振荡,同时测定溶液的pH,若测得溶液的pH____(填序号),则证明NaOH与稀盐酸发生了化学反应。
a.逐渐增大并≥7;b.逐渐减小并≤7;c.始终不变并等于7
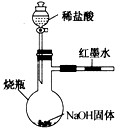
(2)方案二:化学反应通常伴随能量的变化,可借助反应前后的温度变化来判断是否发生了反应。某同学在不使用温度计的情况下,通过上图所示装置进行实验,观察到红墨水向右移动。有的同学提出,该现象不足以证明NaOH与稀盐酸发生了化学反应,他的理由是:①___________________________ ;②___________________________________。
方案三:向NaOH溶液中滴加酚酞试液,溶液显红色,再滴加稀盐酸,若红色消失,则证明NaOH与稀盐酸发生了化学反应。实验中,同学们发现了一个意外现象:向NaOH溶液中滴入酚酞试液,溶液变红,片刻,红色消失。同学们对此进行了探究。
方案三:向NaOH溶液中滴加酚酞试液,溶液显红色,再滴加稀盐酸,若红色消失,则证明NaOH与稀盐酸发生了化学反应。实验中,同学们发现了一个意外现象:向NaOH溶液中滴入酚酞试液,溶液变红,片刻,红色消失。同学们对此进行了探究。
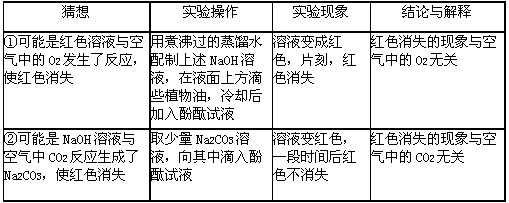
(3)在验证猜想①的实验中,“煮沸”和“滴入植物油”的目的是_____________________。
(4)该小组同学通过查阅资料得知:当选用溶质的质量分数大干10%的氢氧化钠溶液时,就会出现上述意外现象。请你设计实验证明:上述方案中红色消失是NaOH溶液中溶质的质量分数过大所致。你的实验方案是___________________________________________________。
查看习题详情和答案>>
(4)该小组同学通过查阅资料得知:当选用溶质的质量分数大干10%的氢氧化钠溶液时,就会出现上述意外现象。请你设计实验证明:上述方案中红色消失是NaOH溶液中溶质的质量分数过大所致。你的实验方案是___________________________________________________。