网址:http://m.1010jiajiao.com/timu3_id_395985[举报]
(8分)水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。
己知:C (s) + H2O(g) ![]() CO (g) +H2 (g);△H =+131.3kJ•mol-1
CO (g) +H2 (g);△H =+131.3kJ•mol-1
C (s) + O2(g)=CO (g); △H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l); △H = -285.8kJ·mo1-1
⑴将2.4 g 炭转化为水煤气,再完全燃烧,整个过程的△H = kJ·mo1-1。
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中
 提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 。
⑶小亮同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小亮应该选用的试剂是 ,实验时测定的数据除空气的体积外,还需要测定 。
查看习题详情和答案>>水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)![]() CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.

(2)另有一个容积可变的密闭容器.恒温恒压下,向其中加入1.0 mol炭和1.0 mol水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍.平衡时水蒸气的转化率为________;向该容器中补充a mol炭,水蒸气的转化率将________(填“增大”、“减小”、“不变”),再补充a mol水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为________.
(3)己知:C(s)+![]() O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
CO(g)+![]() O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
那么,将2.4 g炭完全转化为水煤气,然后再燃烧,整个过程ΔH=________kJ·mo1-1
水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C(s)+H2O(g)![]() CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
CO(g)+H2(g);ΔH=+131.3 kJ·mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.
请根据上表数据计算出该温度下该反应的平衡常数的数值________
填写表中相应的空格①________、②________;
(2)另有一个容积可变的密闭容器.恒温恒压下,向其中加入1.0 mol炭和1.0 mol水蒸气,发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍,平衡时水蒸气的转化率为________;向该容器中补充a mol炭,水蒸气的转化率将________(填“增大”、“减小”、“不变”).
(3)己知:CO(g)+![]() O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
O2(g)=CO2(g);ΔH=-283.0 kJ·mo1-1
H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mo1-1
C(s)+![]() O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
O2(g)=CO(g);ΔH=-110.5 kJ·mo1-1
那么,将12 g炭完全转化为水煤气,然后再燃烧,整个过程放出________kJ的热量.
(7 分 )水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)≒CO(g) +H2 (g);△H =+131.3kJ•mol-1
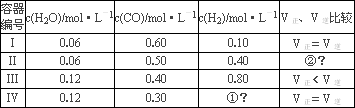
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器编号 | c(H2O)/mol·L-1 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | V正、V逆比较 |
| I | 0.06 | 0.60 | 0.10 | V正=V逆 |
| II | 0.06 | 0.50 | 0.40 | ? |
| III | 0.12 | 0.40 | 0.80 | V正<V逆 |
| IV | 0.12 | 0.30 | ? | V正=V逆 |
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍。平衡时水蒸气的转化率为 ;向该容器中补充 a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O), 最终容器中C16O和C18O 的物质的量之比为 。
(3)己知:C (s) + ![]() O2(g)=CO(g);△H = -110.5kJ·mo1-1
O2(g)=CO(g);△H = -110.5kJ·mo1-1
CO(g) + ![]() O2(g)=CO2 (g);△H =-283.0 kJ·mo1-1
O2(g)=CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + ![]() O2(g) =H2O (g);△H = -241.8kJ·mo1-1
O2(g) =H2O (g);△H = -241.8kJ·mo1-1
那么,将2.4 g 炭完全转化为水煤气,然后再燃烧,整个过程△H = kJ·mo1-1
查看习题详情和答案>>
(7 分 )水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)≒CO (g) +H2 (g);△H =+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
V正、V逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
V正=V逆 |
|
II |
0.06 |
0.50 |
0.40 |
? |
|
III |
0.12 |
0.40 |
0.80 |
V正<V逆 |
|
IV |
0.12 |
0.30 |
? |
V正=V逆 |
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充 a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O), 最终容器中C16O和C18O 的物质的量之比为 。
(3)己知:C (s) + 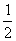 O2(g)=CO
(g);△H = -110.5kJ·mo1-1
O2(g)=CO
(g);△H = -110.5kJ·mo1-1
CO(g) + 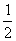 O2(g)
=CO2 (g);△H =-283.0 kJ·mo1-1
O2(g)
=CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + 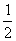 O2
(g) =H2O (g);△H = -241.8kJ·mo1-1
O2
(g) =H2O (g);△H = -241.8kJ·mo1-1
那么,将2.4 g 炭完全转化为水煤气,然后再燃烧,整个过程△H = kJ·mo1-1
查看习题详情和答案>>