网址:http://m.1010jiajiao.com/timu3_id_395510[举报]
A.23.25 mol;5 B.24.5 mol;7
C.24.5 mol;8 D.26.5 mol;6
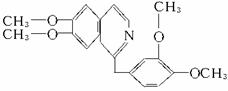
查看习题详情和答案>>鸦片具有复杂的组成,其中的罂粟碱的分子结构如下。鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱、精神颓废、寿命缩短。已知该物质的燃烧产物为CO2、H2O和N2,1 mol该化合物完全燃烧消耗O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是( )

A.23.25 mol;5 B.24.5 mol;7
C.24.5 mol;8 D.26.5 mol;6
查看习题详情和答案>> 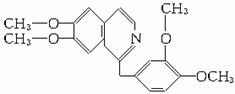
A.23.25 mol;5 B.24.5 mol;7
C.24.5 mol;8 D.26.5 mol;6
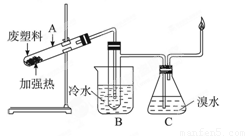
查看习题详情和答案>>(8分)某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
|
产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
|
质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
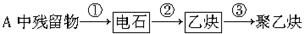
写出反应③的化学方程式: ____________________。
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质,其一氯代物有_____种。
(3)锥形瓶C中观察到的现象______________。
(4)写出C中逸出的气体在工业上的两种用途:________________、_______________。
查看习题详情和答案>>
