摘要:(1) (2) (3) 2008学年第一学年卢湾高级中学高三化学月考试题
网址:http://m.1010jiajiao.com/timu3_id_394670[举报]
仔细分析下列表格中烃的排布规律,判断排列在第12位的烃的同分异构体的数目是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
| C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4Hl0 | … |
| A、3 | B、4 | C、5 | D、6 |
(1)目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1?10nm之间).判断产品中是否含有纳米级碳酸钙的简单实验方法为 .
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g).将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g),其相关数据如下表所示:
①T10C时,该反应的平衡常数K= .
②乙容器中,从开始达到化学平衡时,以v(H2O)表示的速率为 .
(3)臭氧是常见的氧化剂,广泛用于水处理系统.制取臭氧的方法有多种,其中高压放电法和电解纯水法的原理如图1所示,请回答下列问题:
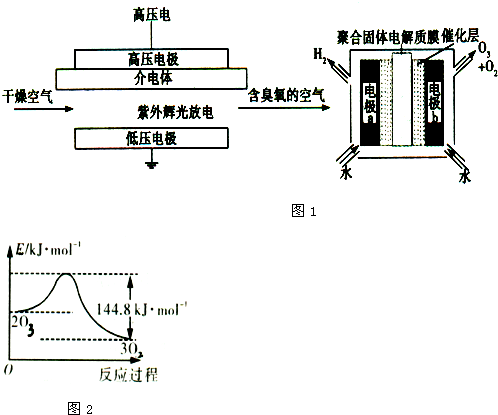
①高压放电法中,发生反应3O2(g)?2O3(g)△H=+144.8KJ.mol-1,t℃时K=3.33×10-77,下列说法正确的是 (填序号).
A.O3转化为O2的反应是放热反应
B.t0C时反应2O3(g)3O2(g)的平衡常数K≈3×1076
C.O3转化为O2的能量变化曲线如图2所示
②电解法中,电极b周围发生的电极反应有 、 ;电解时,H+由电极 经聚合固体电解质膜流向电极 (填“a”或“b”).
查看习题详情和答案>>
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g).将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g),其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(g) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
②乙容器中,从开始达到化学平衡时,以v(H2O)表示的速率为
(3)臭氧是常见的氧化剂,广泛用于水处理系统.制取臭氧的方法有多种,其中高压放电法和电解纯水法的原理如图1所示,请回答下列问题:

①高压放电法中,发生反应3O2(g)?2O3(g)△H=+144.8KJ.mol-1,t℃时K=3.33×10-77,下列说法正确的是
A.O3转化为O2的反应是放热反应
B.t0C时反应2O3(g)3O2(g)的平衡常数K≈3×1076
C.O3转化为O2的能量变化曲线如图2所示
②电解法中,电极b周围发生的电极反应有
某环境监测站每隔一段时间抽取雨水试样,测定其pH,数据如下:
|
查看习题详情和答案>>
(2010?南通模拟)SO2和NOx的排放是造成酸雨的两大罪魁祸首.如图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据.
(1)结合上图数据,判断下列说法正确的是
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少.请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
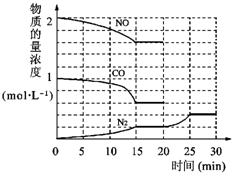
(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO?N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
在上述条件下反应能够自发进行,则反应的△H
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62[c(H+)=2.4×10-4mol/L]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g.若假设雨水的酸性仅由NOx和SO2的排放所致.请计算排放在空气中的NOx和SO2的物质的量之比接近于
查看习题详情和答案>>

(1)结合上图数据,判断下列说法正确的是
BD
BD
.A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少.请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
CaCO3+SO2=CaSO3+CO2或2CaCO3+2SO2+O2=2CaSO4+2CO2
CaCO3+SO2=CaSO3+CO2或2CaCO3+2SO2+O2=2CaSO4+2CO2
.(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO?N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
<
<
0(“>”、“<”、“=”).在该温度下,反应的平衡常数K=5000
5000
.(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62[c(H+)=2.4×10-4mol/L]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g.若假设雨水的酸性仅由NOx和SO2的排放所致.请计算排放在空气中的NOx和SO2的物质的量之比接近于
1:1
1:1
. 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O2
 O2+Hb?CO
O2+Hb?CO实验表明,c(Hb?CO)即使只有c(Hb?O2)的 1/50,也可造成人的智力损伤.
已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol?L-1,若使c(Hb?CO)小于c(Hb?O2)的 1/50,则吸入肺部CO的浓度不能超过
1.0×10-6
1.0×10-6
mol?L-1.(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
已知反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1①为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如右下图所示.反应进行到15min时,NO的平均反应速率为
| 0.4 |
| 15 |
| 0.4 |
| 15 |
②观察在20min~30min内N2(g)发生变化的曲线图,判断引起该变化的条件可能是
b
b
;a.加入催化剂
b.降低体系温度
c.缩小容器体积为0.5L
d.增加CO2的物质的量
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①上述正向反应是:
放热
放热
反应(填“放热”、“吸热”).②某温度下上述反应平衡时,恒容、升高温度,正反应速率
增大
增大
(填“增大”、“减小”或“不变”),容器内混合气体的压强增大
增大
(填“增大”、“减小”或“不变”).③在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
B、C
B、C
(选填A、B、C、D).| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |