摘要:实验室测量时间的仪器是 和 .如上图停表.大表盘中指针转一圈的时间为 .现在停表指示的时间是 秒.
网址:http://m.1010jiajiao.com/timu3_id_3940562[举报]
实验室常用下列装置来制取氧气:
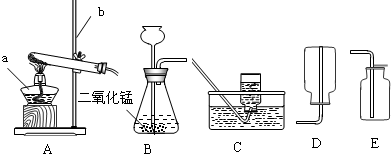
(1)写出图中有标号仪器的名称:a 、b ;
(2)用高锰酸钾制取氧气时,发生反应的文字表达式为 .
(3)实验室常用氯化铵固体与碱石灰固体混和加热来制取氨气.常温下氨气是一种无色、有刺激
性气味的气体,密度比空气小,极易溶于水.制取并收集氨气时,应该从上图中选择的发生
装置是 (填序号),收集装置是 .(填序号)
(4)用E装置收集氧气时,检验氧气是否集满的方法是 .
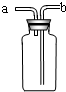
(5)若直接使用如图所示装置收集O2,则O2由 口进入;若将装置中充满水,则O2由 口进入.
(6)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是 (填序号),该反应的文字表达式为 .对此实验,让我们继续思考并研究几个问题:
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
请你分析表中数据并回答:MnO2的用量对反应速率有无影响,如果有,怎样影响? ;
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的实验方案是: .
查看习题详情和答案>>

(1)写出图中有标号仪器的名称:a
(2)用高锰酸钾制取氧气时,发生反应的文字表达式为
(3)实验室常用氯化铵固体与碱石灰固体混和加热来制取氨气.常温下氨气是一种无色、有刺激
性气味的气体,密度比空气小,极易溶于水.制取并收集氨气时,应该从上图中选择的发生
装置是
(4)用E装置收集氧气时,检验氧气是否集满的方法是
(5)若直接使用如图所示装置收集O2,则O2由

(6)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 二氧化锰(MnO2)粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的实验方案是:
实验室常用下列装置来制取氧气:
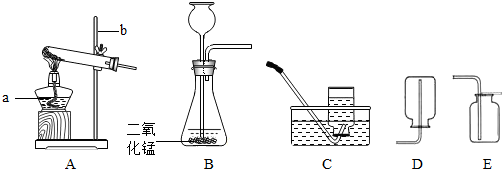
(1)写出图中有标号仪器的名称:a 、b ;
(2)用氯酸钾制取氧气时,发生反应的文字表达式为 .
(3)实验室常用氯化铵固体与碱石灰固体混和加热来制取氨气.常温下氨气是一种无色、有刺激
性气味的气体,密度比空气小,极易溶于水.制取并收集氨气时,应该从上图中选择的发生装置是 ,收集装置是 .
(4)用E装置收集氧气时,检验氧气是否集满的方法是 .
(5)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是 (填序号),其中二氧化锰
起 作用,该反应的文字表达式为 .对此实验,让我们继续思考并研究几个问题:
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
请你分析表中数据并回答:MnO2的用量对反应速率有无影响,如果有,怎样影响?
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的实验方案是:
问题③:还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想: .
查看习题详情和答案>>

(1)写出图中有标号仪器的名称:a
(2)用氯酸钾制取氧气时,发生反应的文字表达式为
(3)实验室常用氯化铵固体与碱石灰固体混和加热来制取氨气.常温下氨气是一种无色、有刺激
性气味的气体,密度比空气小,极易溶于水.制取并收集氨气时,应该从上图中选择的发生装置是
(4)用E装置收集氧气时,检验氧气是否集满的方法是
(5)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是
起
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 二氧化锰( MnO2 )粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的实验方案是:
问题③:还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:
实验室常用如图装置制取气体,请你根据所学知识回答下列问题.
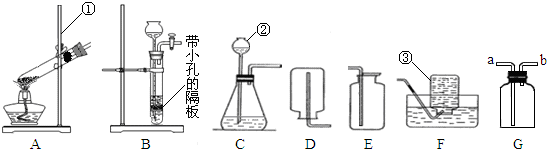
(1)写出编号所指仪器的名称:①
(2)A装置图中有两处明显的错误,请找出错误的地方并把改正的结果填在下列横线上:
①
②
上述装置改进后,请继续回答下列问题.
(3)在实验室中若选用C装置制取氧气,实验时发现此装置制取氧气的反应较为剧烈,为减缓反应速率,可以采取的措施是
问题①:催化剂二氧化锰的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢溶液,采用不同质量的二氧化锰粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
请你分析表中数据并回答:二氧化锰的用量对反应速率有无影响,如果有,怎样影响?
问题②:还有哪些因素可能影响该反应的速率?请写出你的一个猜想
(4)在实验室中若选用A装置制取氧气,请写出制取氧气的反应文字表达式
(5)装置B、C都可以用来制取二氧化碳,比较这两个装置的不同,指出B装置的一个突出优点
(6)硫化氢是一种有毒气体,密度比空气大,能溶于水形成氢硫酸.实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下反应制取硫化氢气体.实验室制取硫化氢气体应选用的发生装置是
查看习题详情和答案>>

(1)写出编号所指仪器的名称:①
铁架台
铁架台
;②长颈漏斗
长颈漏斗
;③集气瓶
集气瓶
.(2)A装置图中有两处明显的错误,请找出错误的地方并把改正的结果填在下列横线上:
①
试管口应该略向下倾斜
试管口应该略向下倾斜
;②
用酒精灯的外焰加热
用酒精灯的外焰加热
.上述装置改进后,请继续回答下列问题.
(3)在实验室中若选用C装置制取氧气,实验时发现此装置制取氧气的反应较为剧烈,为减缓反应速率,可以采取的措施是
将长颈漏斗换作分液漏斗,控制滴加液体的速度
将长颈漏斗换作分液漏斗,控制滴加液体的速度
.请写出用该装置制取氧气的反应文字表达式过氧化氢
水+氧气
| 二氧化锰 |
过氧化氢
水+氧气
.对此实验,让我们继续思考并研究几个问题:| 二氧化锰 |
问题①:催化剂二氧化锰的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢溶液,采用不同质量的二氧化锰粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 二氧化锰粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
在一定范围内,二氧化锰的用量越大,反应越快,当二氧化锰的用量增加到一定的值后,继续增大二氧化锰的用量,反应速率不再增大
在一定范围内,二氧化锰的用量越大,反应越快,当二氧化锰的用量增加到一定的值后,继续增大二氧化锰的用量,反应速率不再增大
.问题②:还有哪些因素可能影响该反应的速率?请写出你的一个猜想
二氧化锰颗粒大小
二氧化锰颗粒大小
.(4)在实验室中若选用A装置制取氧气,请写出制取氧气的反应文字表达式
高锰酸钾
锰酸钾+二氧化锰+氧气
| 加热 |
高锰酸钾
锰酸钾+二氧化锰+氧气
.若用装置E收集氧气,验满氧气的方法是| 加热 |
将带火星的木条放在集气瓶口,若木条复燃则说明氧气收集满了
将带火星的木条放在集气瓶口,若木条复燃则说明氧气收集满了
.若用装置F收集氧气,实验结束后发现收集到的氧气不纯,原因是未等导管口出现连续均匀的气泡冒出时就收集气体
未等导管口出现连续均匀的气泡冒出时就收集气体
,实验结束后拆装置,要先将导管从水槽中移出
将导管从水槽中移出
,后熄灭酒精灯
熄灭酒精灯
,这样做的理由是为了防止水槽中的水倒吸入试管中
为了防止水槽中的水倒吸入试管中
.(5)装置B、C都可以用来制取二氧化碳,比较这两个装置的不同,指出B装置的一个突出优点
可以随时控制反应的开始或停止
可以随时控制反应的开始或停止
,请写出实验室制取二氧化碳的反应文字表达式碳酸钙+盐酸→氯化钙+水+二氧化碳
碳酸钙+盐酸→氯化钙+水+二氧化碳
.(6)硫化氢是一种有毒气体,密度比空气大,能溶于水形成氢硫酸.实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下反应制取硫化氢气体.实验室制取硫化氢气体应选用的发生装置是
B或C
B或C
,若收集装置选用G,则硫化氢气体应从a
a
(填“a”或“b”)导管进入集气瓶中.(15分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为 。
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 ; | 白色沉淀产生 | 该反应的化学方程式: ; |
| (2)将上述反应后的混合物过滤,取滤液加入 。 | 。 | 证明猜想Ⅱ正确 |
【实验探究2】小红同学设计如下图所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:
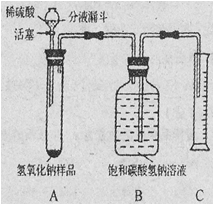
①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液220mL。
请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是 ;
(2)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是 ;
(3)试管中原有的空气对实验结果是否有明显影响? (填“有”或“没有”)
(4)变质氢氧化钠样品中碳酸钠的质量分数为 。(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如下图所示的实验流程。
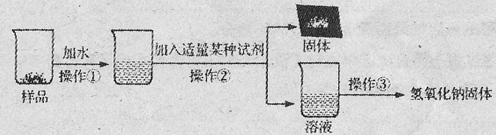
请回答下列问题:
(1)操作①、②、③的名称分别为 ,为了使样品充分溶解,操作①中还要用到的玻璃仪器是 ;
(2)该实验中发生反应的化学方程式为 ;
(3)最终所得氢氧化钠固体质量 变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”)。
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质样品中某成分的含量,以及除杂提纯物质。为了得到可靠的实验结果,探究过程中你需要思考的问题有 (填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(2)实验探究Ⅰ中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,分别是 。 查看习题详情和答案>>
实验室常用下列装置来制取氧气:

(1)写出图中有标号仪器的名称:a______、b______;
(2)用高锰酸钾制取氧气时,发生反应的文字表达式为______.
(3)实验室常用氯化铵固体与碱石灰固体混和加热来制取氨气.常温下氨气是一种无色、有刺激
性气味的气体,密度比空气小,极易溶于水.制取并收集氨气时,应该从上图中选择的发生
装置是______(填序号),收集装置是______.(填序号)
(4)用E装置收集氧气时,检验氧气是否集满的方法是______.
(5)若直接使用如图所示装置收集O2,则O2由______口进入;若将装置中充满水,则O2由______口进入.

(6)用双氧水和二氧化锰来制取氧气时,可选用的发生装置是______(填序号),该反应的文字表达式为______.对此实验,让我们继续思考并研究几个问题:
问题①:催化剂二氧化锰(MnO2)的用量对反应速率有没有影响?
我的实验方案是:每次均用30mL10%的过氧化氢(H2O2)溶液,采用不同量二氧化锰(MnO2)粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 二氧化锰(MnO2)粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
问题②:过氧化氢(H2O2)溶液的浓度对反应速率有没有影响?你的实验方案是:______. 查看习题详情和答案>>