摘要:20.在常温下100mLpH=10的KOH溶液中.加入pH=4的一元酸HA溶液至pH刚好等于7.则对反应后溶液的叙述正确的是 A.V≥200mL B.V≤200mL C.c(H+)= c(OH-)< c(K+)< c(A-) D.c(A-)= c(K+)
网址:http://m.1010jiajiao.com/timu3_id_393750[举报]
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素C、D原子的最外层上均有一个未成对电子.下列说法正确的是( )
查看习题详情和答案>>
 (2011?顺德区模拟)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(2011?顺德区模拟)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
降低了活化能
降低了活化能
.(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为
H2O2?H++HO2-
H2O2?H++HO2-
.(3)实验①和②的目的是
探究浓度对反应速率的影响
探究浓度对反应速率的影响
.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)
向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)
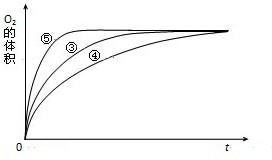
.(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.
分析上图能够得出的实验结论是
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
.下列关于浓硫酸的叙述正确的是( )
| A、浓硫酸具有吸水性,因而能使蔗糖炭化 | B、浓硫酸在常温下能够使铁、铝等金属钝化 | C、浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | D、浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
(2010?朝阳区模拟)钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4.
II.将SiCl4分离,得到纯净的TiCl4.
III.在TiCl4中加水、加热,水解得到沉淀TiO2?xH2O.
IV.TiO2?Xh2O高温分解得到TiO2.
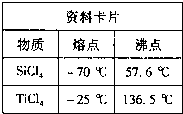
①TiCl4与SiCl4在常温下的状态是
②III中反应的化学方程式是
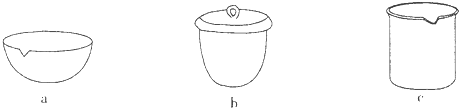
IV在实验室完成,应将TiO2?xH2O放在
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O,其过程大致如下:
a.O2→2O b.2O+H2O→2OH(羟基) c.OH+OH→H2O2
①b中破坏的是
②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的
(3)某研究小组用下列装置模拟“生态马路”部分原理.(夹持装置已略去)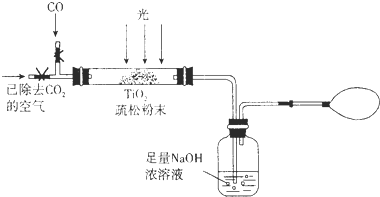
①如缓通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重11g,则CO的转化率为
②当CO气体全部通入后,还要通一会儿空气,其目的是
查看习题详情和答案>>
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4.
II.将SiCl4分离,得到纯净的TiCl4.
III.在TiCl4中加水、加热,水解得到沉淀TiO2?xH2O.
IV.TiO2?Xh2O高温分解得到TiO2.

①TiCl4与SiCl4在常温下的状态是
液态
液态
.II中所采取的操作名称是蒸馏
蒸馏
.②III中反应的化学方程式是
TiCl4+(x+2)H2O
TiO2?xH2O↓+4HCl
| ||
TiCl4+(x+2)H2O
TiO2?xH2O↓+4HCl
.
| ||
IV在实验室完成,应将TiO2?xH2O放在
b
b
(填仪器编号)中加热.
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O,其过程大致如下:
a.O2→2O b.2O+H2O→2OH(羟基) c.OH+OH→H2O2
①b中破坏的是
极性共价键
极性共价键
(填“极性共价键”或“非极性共价键”).②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的
氧化性
氧化性
(填“氧化性”或“还原性”).(3)某研究小组用下列装置模拟“生态马路”部分原理.(夹持装置已略去)

①如缓通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重11g,则CO的转化率为
25%
25%
.②当CO气体全部通入后,还要通一会儿空气,其目的是
将残留在装置中的CO2气体排出,被NaOH溶液吸收,减少误差
将残留在装置中的CO2气体排出,被NaOH溶液吸收,减少误差
.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)这九种元素中最不活泼的是
(2)①、④两种元素的最高价氧化物对应的水化物相互反应的化学方程式是
(3)⑥元素的氢化物是
(4)高温下灼烧含元素①的化合物时,火焰呈
(5)①、②、③三种元素金属性活动顺序由强到弱为
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(1)这九种元素中最不活泼的是
Ar
Ar
(填元素符号),最高价氧化物对应水化物碱性最强的是KOH
KOH
(填化学式,下同),最高价氧化物对应水化物酸性最强的是HClO4
HClO4
(填化学式,下同),最高价氧化物对应水化物成两性的是Al(OH)3
Al(OH)3
(填化学式,下同),(2)①、④两种元素的最高价氧化物对应的水化物相互反应的化学方程式是
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+NaOH=NaAlO2+2H2O
.(3)⑥元素的氢化物是
H2O
H2O
(填化学式),该氢化物在常温下与②发生反应的化学方程式为2K+H2O=2KOH+H2↑
2K+H2O=2KOH+H2↑
,离子方程式为2K+H2O=2K++2OH-+H2↑
2K+H2O=2K++2OH-+H2↑
,所得溶液的pH>
>
(填“<”、“>”或“=”)7.(4)高温下灼烧含元素①的化合物时,火焰呈
黄
黄
色.(5)①、②、③三种元素金属性活动顺序由强到弱为
K>Na>Mg
K>Na>Mg
,判断的依据是与水反应的剧烈程度K>Na>Mg
与水反应的剧烈程度K>Na>Mg
(写出一条就可以).